-
根据下表提供的数据,判断在等浓度的NaClO、NaHCO3混合溶液中,各种离子浓度关系正确的是
化学式
电离常数
HClO
K=3×10-8
H2CO3
K1=4.3×10-7
K2=5.6×10-11
A. c(HCO3― )>c(ClO― )>c(OH― )
B. c(ClO― )>c(HCO3― )>c(H+)
C. c(HClO)+c(ClO― )=c(HCO3― )+c(H2CO3)
D. c(Na+)+c(H+)=c(HCO3― )+c(ClO― )+c(OH― )
难度: 中等查看答案及解析
-
下列滴定中,指示剂的选择或滴定终点颜色变化有错误的是( )
提示:2KMnO4+5K2SO3+3H2SO4=6K2SO4+2MnSO4+3H2O、I2+Na2S=2NaI+S↓
选项
滴定管中的溶液
锥形瓶中的溶液
指示剂
滴定终点颜色变化
A
NaOH溶液
CH3COOH溶液
酚酞
无色→浅红色
B
HCl溶液
氨水
甲基橙
黄色→橙色
C
酸性KMnO4溶液
K2SO3溶液
无
无色→浅紫红色
D
碘水
Na2S溶液
淀粉
蓝色→无色
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列说法或表示方法正确的是( )
A.若将等量的硫蒸气和硫固体分别完全燃烧,后者放出热量多
B.由“C(石墨)=C(金刚石) ΔH= +1.9kJ·mol-1”可知,金刚石比石墨稳定
C.在101kPa时,2g H2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)=2H2O(l) ΔH= +285.8kJ·mol-1
D.在稀溶液中:H+(aq)+OH-(aq)=H2O(l) ΔH= -57.3kJ·mol-1,若将含1mol CH3COOH与含1mol NaOH的溶液混合,放出的热量小于57.3kJ
难度: 简单查看答案及解析
-
下列金属防护的方法中,应用了牺牲阳极的阴极保护法的是
A.钢铁船身嵌入锌 B.钢闸门与直流电源负极相连
C.健身器材刷油漆 D.车圈、车铃钢上镀铬
难度: 简单查看答案及解析
-
化学知识在生产和生活中有着重要的应用。下列说法中错误的是( )
A.明矾常作为净水剂,双氧水通常可用于作杀菌消毒
B.误食重金属盐引起的人体中毒,可以喝大量的浓盐水解毒
C.金属钠、镁等活泼金属着火时,不能使用泡沫灭火器来灭火
D.进行胃镜透视时,不能用碳酸钡代替硫酸钡作为钡餐
难度: 中等查看答案及解析
-
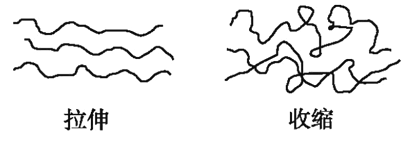
橡皮筋在拉伸和收缩状态时结构如图,在其拉伸过程中有放热现象。25℃、101kPa时,下列过程的焓变、熵变和自发性与橡皮筋从拉伸状态到收缩状态一致的是( )
A. CaCO3=CaO+CO2↑
B. NaOH的溶解
C. 2H2+O2=2H2O
D. Ba(OH)2•8H2O+2NH4Cl=BaCl2+2NH3↑+10H2O
难度: 中等查看答案及解析
-
物质的量浓度相同的下列溶液,由水电离出的c(H+)浓度最小的是( )
A.NaHCO3 B.Na2SO4 C.NaHSO4 D.NH3·H2O
难度: 中等查看答案及解析
-
下列方程式书写正确的是( )
A.NaHCO3在水溶液中的电离方程式:NaHCO3=Na++H++CO32-
B.H2SO3的电离方程式:H2SO3
2H++SO32-
C.PO43-的水解方程式:PO43-+H2O
HPO42-+OH-
D.CaCO3沉淀溶解平衡方程式:CaCO3(s)=Ca2+(aq)+CO32-(aq)
难度: 中等查看答案及解析
-
根据下列实验不能证明一元酸HR为弱酸的是( )
A.室温下,NaR溶液的pH大于7
B.HR溶液加入少量NaR固体,溶解后溶液的pH变大
C.HR溶液的导电性比盐酸弱
D.0.01mol·L-1的HR溶液pH=2.8
难度: 中等查看答案及解析
-
下列实验事实不能用平衡移动原理解释的是( )
A.pH=11的氨水稀释10倍后溶液pH>10
B.将饱和氯化铁溶液滴入沸水,溶液变成红褐色
C.对于CO(g)+NO2(g)
CO2(g)+NO(g)的平衡体系,增大压强可使颜色变深
D.水垢中含有CaSO4,可先用Na2CO3溶液浸泡处理,而后用盐酸去除
难度: 中等查看答案及解析
-
某密闭容器中发生反应:X(g)+3Y(g)
2Z(g) ΔH<0。如图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法错误的是( )

A.t2时加入了催化剂
B.t3时减小了压强
C.t5时升高了温度
D.t4~t5时间内X转化率最低
难度: 中等查看答案及解析
-
常温下,由水电离产生的c(H+)与c(OH-)的乘积为10-24,下列各组离子可能大量共存的是( )
A.Al3+、Cl-、NH4+、SO42- B.K+、Fe2+、Cl-、NO3-
C.K+、Ba2+、NO3-、SO42- D.K+、NH4+、ClO-、I-
难度: 中等查看答案及解析
-
一定温度下,可逆反应2NO2
2NO+O2在体积不变的密闭容器中反应,达到平衡状态的标志是( )
①单位时间内生成nmolO2的同时生成2nmolNO2
②混合气体的平均相对分子质量不再改变的状态
③混合气体的密度不再改变的状态
④混合气体的颜色不再改变的状态
⑤NO2、NO、O2的物质的量浓度比为2:2:1的状态
A.①②③④ B.①②④ C.②③⑤ D.①②③④⑤
难度: 中等查看答案及解析
-
下列固体物质溶于水,再将其溶液加热,蒸发结晶、再灼烧,能得到化学组成与原固体物质相同的是( )
①胆矾 ②氯化铝 ③硫酸铝 ④Na2CO3⑤NaHCO3⑥高锰酸钾
A. ③④ B. ①③④ C. ①②③④⑤ D. 全部
难度: 简单查看答案及解析
-
常温下,浓度相同的稀溶液:①氨水、②NH4Al(SO4)2溶液、③CH3COONH4溶液、④NH4Cl溶液中,c(NH4+)由大到小的排列顺序为( )
A.①>②>④> ③ B.②>④>③>① C.②>①>③>④ D.②>①>④>③
难度: 中等查看答案及解析
-
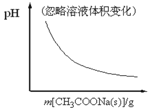
下列各可逆反应达平衡后,改变反应条件,其变化趋势正确的是( )
A.CH3COOH
CH3COO-+H+
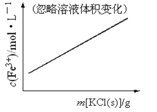
B.FeCl3+3KSCN
Fe(SCN)3+3KCl
C.N2(g)+3H2(g)
2NH3(g)

D.CH3OCH3(g)+3H2O(g)
6H2(g)+2CO2(g) ΔH>0

难度: 中等查看答案及解析
-
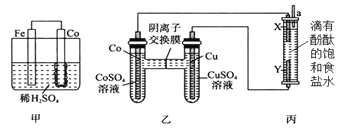
硼化钒(VB2)-空气电池是目前储电能力最高的电池,电池示意图如图所示,该电池工作时反应为:4VB2+11O2═4B2O3+2V2O5.下列说法正确的是( )
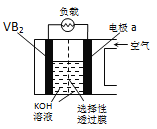
A.电极a为电池负极
B.图中选择性透过膜只能让阳离子选择性透过
C.电子由VB2极经KOH溶液流向a电极
D.VB2极发生的电极反应为:2VB2+22OH--22e-═V2O5+2B2O3+11H2O
难度: 中等查看答案及解析
-
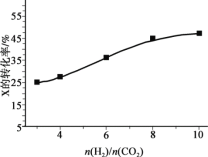
利用CO和H2在催化剂的作用下合成甲醇,发生的反应如下:CO(g)+2H2(g)
CH3OH(g).在体积一定的密闭容器中按物质的量之比1:2充入CO和H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示。下列说法正确的是
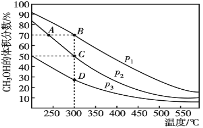
A. 该反应的△H<0,且p1<p2
B. 反应速率:ν逆(状态A)>ν逆(状态B)
C. 在C点时,CO转化率为75%
D. 在恒温恒压条件下向密闭容器中充入不同量的CH3OH,达平衡时CH3OH的体积分数不同
难度: 困难查看答案及解析
-
某温度时,AgCl(s)
Ag+(aq)+Cl-(aq)在水中的溶解平衡曲线如图。下列说法正确的是( )
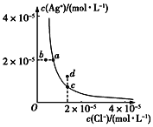
A.加入AgNO3可以使溶液由c点变到d点
B.加入NaCl固体则AgCl的溶解度减小,Ksp也减小
C.蒸发溶液可以实现b点到a点的转化
D.图中d点对应的是过饱和溶液
难度: 中等查看答案及解析
-
常温下,等体积酸和碱的溶液混和后,溶液pH<7的是( )
A.pH之和为14的硝酸和氢氧化钾溶液
B.pH=5的盐酸和pH=9的氨水溶液
C.物质的量浓度相等的醋酸和苛性钠溶液
D.pH之和为13的硫酸和氢氧化钡溶液
难度: 中等查看答案及解析
-
常温下,用0.1000mol·L-1盐酸滴定20.00mL未知浓度一元弱碱MOH溶液,滴定曲线如图所示。下列有关说法错误的是( )
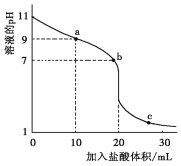
A.该一元碱溶液浓度为0.1000mol·L-1
B.a、b、c点水的电离程度逐渐增大
C.b点:c(M+)=c(Cl-)
D.常温下,MOH的电离常数Kb=1×10-5
难度: 中等查看答案及解析
-
下列实验操作不能达到实验目的是( )
实验操作
实验目的
A
向2支盛有2mL5%H2O2的试管中分别滴加1mL同浓度的FeCl3溶液和CuSO4溶液
探究不同催化剂的催化效率
B
取2mL1.0mol/LAgNO3溶液,先滴5滴1.0mol/LNaCl溶液,再滴5滴1.0mol/LNaI溶液,看到白色沉淀变黄色
验证AgCl和AgI的Ksp大小
C
混合前分别用冲洗干净的温度计测量50mL0.50mol/LHCl溶液与50mL0.55mol/LNaOH溶液的温度
测定中和反应反应热
D
等浓度等体积的盐酸与醋酸分别与镁条反应
比较酸溶液中的c(H+)的大小
A.A B.B C.C D.D
难度: 中等查看答案及解析