-
用NA表示阿伏德罗常数,下列叙述正确的是 ( )
A. 标准状况下,22.4LH2O含有的分子数为1 NA
B. 常温常压下,1.06g Na2CO3含有的Na+离子数为0.01NA
C. 标准状况下,1 NA个CO2分子占有的体积大约为22.4L
D. 物质的量浓度为0.6mol/L的MgCl2溶液中,含有Cl- 个数为1.2 NA个
难度: 中等查看答案及解析
-
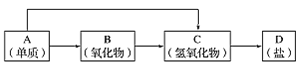
下列物质按照酸、碱、盐的顺序排列的是( )
A.硫酸、纯碱、食盐 B.次氯酸、烧碱、硫酸铜
C.碳酸、氧化铁、碳酸钠 D.醋酸、熟石灰、苛性钠
难度: 简单查看答案及解析
-
下列每组物质中含有的化学键类型相同的是
A.NaCl、HCl、H2O、NaOH
B.Cl2、Na2S、HCl、SO2
C.HBr、CO2、H2O、CS2
D.Na2O2、H2O2、H2O、O3
难度: 简单查看答案及解析
-
下列有关化学用语表示正确的是( )
A.
的结构示意图:
B.质子数为53、中子数为78的碘原子:
C.N2的结构式:N≡N
D.H2O2的电子式:
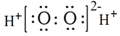
难度: 中等查看答案及解析
-
节日燃放的五彩缤纷的烟花与高中化学中“焰色试验”知识相关。下列说法中正确的是( )
A.焰色试验是化学变化
B.用稀盐酸清洗做焰色试验的铂丝(或铁丝)
C.焰色试验均应透过蓝色钴玻璃观察
D.焰色试验可区分NaCl与Na2CO3固体
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.2gH2含2molH
B.在周期表的过渡元素中寻找半导体材料
C.2molH2O的摩尔质量是1molH2O摩尔质量的两倍
D.1H、2H、 3H互为同素异形体
难度: 简单查看答案及解析
-
下列溶液中溶质的物质的量浓度为1mol·L-1的是( )
A.将40g氢氧化钠溶解于1L水中
B.将22.4L氯化氢气体溶于水配成1L溶液
C.将1L10mol·L-1的浓盐酸与9L水混合
D.将10.6g碳酸钠溶解于水得到100mL溶液
难度: 简单查看答案及解析
-
某元素阳离子(X+)的质量数为23,原子核内有12个中子,该阳离子的核外电子数为
A.13 B.12 C.11 D.10
难度: 简单查看答案及解析
-
运用元素周期律分析下面的推断,其中不正确的是( )
A.HBrO4的酸性比HIO4的酸性弱
B.钠与水反应比锂(Li)与水反应剧烈
C.砹(At2)单质为有色固体,AgAt难溶于水也不溶于稀硝酸
D.在氧气中,铷(Rb)的燃烧产物比钠的燃烧产物更复杂
难度: 简单查看答案及解析
-
实验室用下列两种方法制氯气:①用含有HCl4mol 的浓盐酸与足量的MnO2反应,②用1molMnO2与足量的浓盐酸反应。所得的氯气( )
A.①比②多 B.②比①多 C.一样多 D.无法比较
难度: 简单查看答案及解析
-
在下列溶液中加入KSCN溶液,溶液不会显红色的是( )
A.加入足量铁粉后的Fe2(SO4)3溶液 B.Fe在Cl2中燃烧所得产物的水溶液
C.长期暴露在空气中的绿矾溶液 D.加入高锰酸钾溶液后的FeSO4溶液
难度: 简单查看答案及解析