-
下列关于热化学方程式的叙述正确的是
A.已知C(石墨,s)=C(金刚石,s) ΔH>0,则金刚石比石墨稳定
B.已知2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ•mol -1,则H2燃烧热为241.8kJ•mol -1
C.S(g)+O2(g) =SO2(g) ΔH1;S(s)+O2(g) =SO2(g) ΔH2 则ΔH1 < ΔH2
D.在稀溶液中:H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ•mol-1,若将0.5 mol •L -1的稀 H2SO4与1 mol •L -1的NaOH的溶液等体积混合,放出的热量等于57.3 kJ
难度: 简单查看答案及解析
-
周期表中共有18个纵行,从左到右分别为1-18列,按这种规定,下列说法正确的是
A.第1列是碱金属
B.只有第2列的元素原子最外层电子排布为ns2
C.第1列和第18列所含元素种类相同且最多
D.第8列没有非金属元素
难度: 中等查看答案及解析
-
如图是生产水煤气的反应:C(s)+H2O(g)
CO(g)+H2(g)能量变化图,由图可判断下列说法正确的是
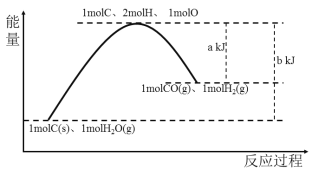
A.容器内充入1molCO、1molH2后充分反应,放出(b-a)kJ的热量
B.C(s)+H2O(g)
CO(g)+H2(g) ΔH=-(b-a) kJ·mol -1
C.该反应过程中既有能量的吸收又有能量的释放
D.加入催化剂可以减小(b-a)的值,从而提高反应速率
难度: 中等查看答案及解析
-
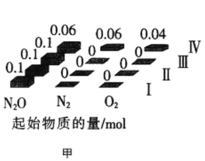
氮气可以作食品包装、灯泡等的填充气。一种实验室制备氮气的方法是:NH4Cl + NaNO2 = NaCl + 2H2O + N2↑ 。反应发生后即停止加热,反应仍可持续进行,直至反应完全。下列说法正确的是
A.该反应只有在低温下才能自发进行
B.NH4Cl的电子式:
C.元素的电负性:Cl>O>H
D.①和②示意图表示的钠原子,电离出最外层一个电子所需要的能量:①>②
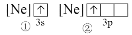
难度: 中等查看答案及解析
-
已知反应X(g)+3Y(g)
2Z(g) ΔH=-a kJ·mol -1 ,一定条件下,1molX和3 mol Y在2L恒容密闭容器中发生反应,10min时测得Y 的物质的量为2.4 mol。下列说法正确的是
A.10min时,容器内的压强是反应前的0.9倍
B.10min 时,X 的转化率为80%
C.10min内,用Y表示的平均反应速率为0.03 mol·L-1·s-1
D.前5分钟内,X 和Y 反应放出的热量等于0.1a kJ
难度: 中等查看答案及解析
-
常温下,下列各组离子一定能在指定溶液中大量共存的是
A.c水(H+)=1×10-12 mol ·L -1的溶液:Al3+、Fe3+、Cl-、SO42-
B.
=1×10-13mol·L -1的溶液:NH4+、Ca2+、Cl-、NO3-
C.澄清透明的无色溶液:K+、NH4+、MnO4-、HCO3-
D.和Al反应放出H2的溶液:Mg2+、Cu2+、NO3-、SO42-
难度: 中等查看答案及解析
-
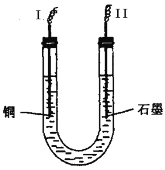
如图是利用盐桥电池从某些含碘物质中提取碘的两个装置,下列说法中正确的是( )
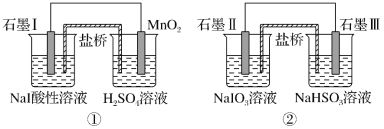
A.两个装置中,石墨I和石墨Ⅱ均作负极
B.碘元素在装置①中被还原,在装置②中被氧化
C.装置①中MnO2的电极反应式为MnO2+2H2O+2e-=Mn2++4OH-
D.装置①、②中的反应生成等量的I2时,导线上通过的电子数之比为1∶5
难度: 中等查看答案及解析
-
有关下列说法中,正确的是
A.用标准盐酸滴定未知浓度的NaOH溶液,滴定前酸式滴定管尖嘴有气泡未排出,滴定后气泡消失,会造成测定结果偏低
B.工业废水中的Cu2+、Hg2+等重金属阳离子可以通过加入FeS除去
C.工业上常在铁板表面镀上一层锡(俗称马口铁)来防止铁板表面破损后发生电化学腐蚀
D.等体积的pH均为2的酸HA和HB的溶液分别与足量的铁粉反应,HA放出的H2多,说明HA酸性强
难度: 困难查看答案及解析
-
氯化亚砜(SOCl2)是一种很重要的化学试剂,可以作为氯化剂和脱水剂。下列关于氯化亚砜分子的几何构型和中心原子( S )采取杂化方式的说法正确的是
A.三角锥型、sp3 B.平面三角形、sp3
C.平面三角形、sp2 D.三角锥型、sp2
难度: 简单查看答案及解析
-
根据图海水综合利用的工业流程图判断,下列说法正确的是
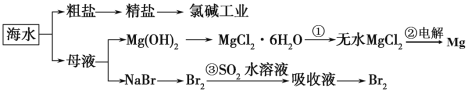
A.过程①中将MgCl2·6H2O灼烧即可制得无水MgCl2
B.在工业上可用电解MgCl2溶液的方法生产金属镁
C.过程③反应后溶液呈强酸性,故生产中需解决其对金属设备的腐蚀问题
D.氯碱工业生产中适当增加电流强度可增大电解反应的转化率
难度: 中等查看答案及解析
-
对下列图示实验的描述正确的是
A.图1所示的实验:钢闸门连在外接电源的负极上可以对其进行保护

B.图2所示的实验:用NaOH溶液滴定盐酸
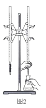
C.图3所示的实验:用浓硫酸和NaOH溶液反应测定中和热
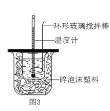
D.图4所示的实验:根据两烧瓶中气体颜色的变化(热水中变深、冰水中变浅)判断2NO2(g)
N2O4(g)正反应是吸热反应
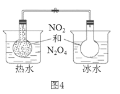
难度: 中等查看答案及解析
-
NaClO2( 亚氯酸纳)是常用的消毒剂和漂白剂,工业上可采用电解法制备,工作原理如图所示。下列叙述正确的是

A.若直流电源为铅蓄电池,则b极为Pb
B.阳极反应式为ClO2+e-=ClO2-
C.交换膜左测NaOH 的物质的量不变,气体X 为Cl2
D.制备18.1g NaClO2时理论上有0.2molNa+由交换膜左侧向右侧迁移
难度: 中等查看答案及解析
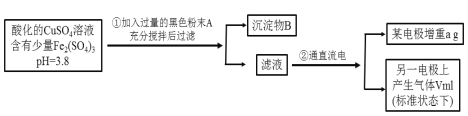
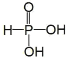 ,二元中强酸)均是重要的精细化工产品。
,二元中强酸)均是重要的精细化工产品。