-
化学反应原理对于研究化学物质有十分重要的意义。
(1)已知次磷酸(H3PO2,一元中强酸)和亚磷酸(H3PO3,结构式为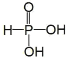 ,二元中强酸)均是重要的精细化工产品。
,二元中强酸)均是重要的精细化工产品。
①写出次磷酸的结构式:_____________________________________。
②已知某温度下0.01 mol·L-1的NaOH溶液pH=10,将该NaOH溶液与等浓度等体积的次磷酸溶液混合,混合后溶液pH=7,则此时c(OH-)—c(H3PO2)=___________。(用具体数值表示)
(2)实验室配制FeCl3溶液时,需要将FeCl3固体溶解在较浓的盐酸中,其原因是_______________________________________________________(用离子方程式和必要的文字说明)。
已知25℃时,Fe(OH)3的Ksp=4.0×10-38,配制100ml 5 mol·L-1的FeCl3溶液,至少需要加入_______mL 2 mol·L-1的盐酸(忽略加入盐酸的体积)。
(3)工业废水中的Cr2O72-对生态系统有很大损害。常用的处理方法有两种。
①还原沉淀法:Cr2O72- Cr3+
Cr3+ Cr(OH)3。常温下,要使Cr3+沉淀完全,溶液的pH应调至________。(已知Cr(OH)3的Ksp=10-32)
Cr(OH)3。常温下,要使Cr3+沉淀完全,溶液的pH应调至________。(已知Cr(OH)3的Ksp=10-32)
②电解法:用铁和石墨做电极,电解产生的还原剂将Cr2O72-还原成Cr3+,最终产生Cr(OH)3沉淀。若有1mol Cr2O72-被还原,理论上导线中通过___________mol电子。
-
磷的单质和化合物都是重要的化工产品。查阅资料可知:亚磷酸(H3PO3)、次磷酸(H3PO2)以及它们的盐都有较强的还原性,可用于化学镀银或镀镍。亚磷酸是中强酸,它与足量的NaOH溶液反应生成 Na2HPO3。试回答下列问题:
(1)Na2HPO3中P的化合价为____。
(2)Na2HPO3是____(填“正盐”或“酸式盐”),其溶液的pH____(填“>”、“=”或“<”)7。
(3)次磷酸钠(NaH2PO2)可用于化学镀镍。镀镍溶液中含Ni2+和H2PO2-,在酸性条件下发生下述反应: Ni2++ H2PO2-+ = Ni+ H2PO3-+_____。
①请配平化学方程式___。
②依据化学方程式,反应消耗6 mol H2PO2-时,转移电子数为_____。
-
(12分)次磷酸(H3PO2)是一种精细化工产品,是一元中强酸,具有较强还原性。回答下列问题:
(1)H3PO2及NaH2PO2均可将溶液中的Ag+还原为Ag,从而可用于化学镀银。
①在H3PO2中,磷元素的化合价为 ;在酸性环境中,利用(H3PO2)进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4︰1,则氧化产物为: (填化学式)。
②NaH2PO2是 (填“正盐”还是“酸式盐”),其溶液中离子浓度由大到小的顺序应为
③0.2 mol·L-1 H3PO2溶液与0.2mol·L-1NaOH溶液等体积混合后所得溶液中:
c(H2PO2-)+c(OH-)-c(H+)= mol·L-1。(溶液体积变化忽略不计)
(2)次磷酸(H3PO2)可以通过电解的方法制备。工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过):
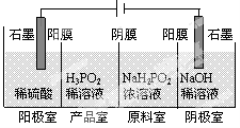
①写出阳极的电极反应式
②分析产品室可得到H3PO2的原因 (用离子方程式表示)
-
铜、磷及其化合物在生产、生活中有重要的用途,回答下列问题:
(1)磷的一种化合物叫亚磷酸(H3PO3)。已知:
Ⅰ、0.1mol/L H3PO3溶液的pH=1.7;
Ⅱ、H3PO3与NaOH反应只生成Na2HPO3和NaH2PO3两种盐;
Ⅲ、H3PO3和碘水反应,碘水棕黄色褪去,再加AgNO3有黄色沉淀生成.
①关于H3PO3的说法:a强酸;b弱酸;c二元酸;d三元酸;e氧化性酸;f还原性酸,其中正确的是__________
A.bdf B.bcf C.ade D.bce,
②写出H3PO3与少量NaOH溶液反应的离子方程式__________;
③Na2HPO3为__________(填“正盐”或“酸式盐”)
(2)碘化亚铜可作催化剂,饲料添加剂等,是难溶于水的固体.铜可以与氢碘酸发生置换反应得到氢气,试从离子浓度对离子反应方向影响的角度解释此反应能够发生的原因__________,CuSO4溶液也能使淀粉-KI试纸变蓝,用离子方程式说明其原理__________;
(3)纳米氧化亚铜是一种具有良好光电效应的材料,工业上制备它的方法之一是:先向KOH溶液中加入一定量的CuSO4溶液,再加入一定量的肼(N2H4),加热并保持反应体系的温度在90℃,反应完全后,分离、洗涤、真空干燥所得到的固体样品。检验反应混合体系内纳米Cu2O已经生成的实验方法的名称是__________。
-
次磷酸(H3PO2)是一种精细磷化工产品,具有较强还原性,回答下列问题:
(1)H3PO2是一元中强酸,写出其电离方程式 。
(2)H3PO2及NaH2PO2均可将溶液中的Ag+还原为银,从而可用于化学镀银。
①H3PO2中,P元素的化合价为 。
②利用H3PO2进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4:1,则氧化产物为 (填化学式)。
③NaH2PO2为 (填“正盐”或“酸式盐”)
(3)H3PO2的工业制法是:将白磷(P4)与Ba(OH)2溶液反应生成PH3气体和Ba(H2PO2)2,后者再与H2SO4反应。写出白磷与Ba(OH)2溶液反应的化学方程式: 。
-
利用化学反应原理研究生产、生活中的实际问题具有十分重要的意义:
(Ⅰ)氮气和氢气合成氨是化学工业中极为重要的反应,其热化学方程式可表示为:N2(g)+3H2(g)  2NH3(g) ΔH=-92 kJ·mol-1。请回答下列问题:
2NH3(g) ΔH=-92 kJ·mol-1。请回答下列问题:
(1)取1 mol N2(g)和3 mol H2(g)放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量_____92 kJ(填“大于”“等于”或“小于”),原因是_______;若加入催化剂,ΔH (填“变大”“变小”或“不变”)。
(2)已知:分别破坏1 mol N≡N键、1 mol H—H键需要吸收的能量为:946 kJ、436 kJ,则破坏1 mol N—H键需要吸收的能量为______kJ。
(3)N2H4可视为:NH3分子中的H被—NH2取代的产物。发射卫星用N2H4(g)为燃料,NO2为氧化剂生成N2和H2O(g)。
已知:N2(g)+2O2(g)===2NO2(g) ΔH1=+67.7 kJ·mol-1
N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH2=-534 kJ·mol-1。
则:1 mol N2H4完全反应的热化学方程式为________。
(Ⅱ)某铅蓄电池的正、负极标记被磨损。试用下图装置设计实验,识别出此铅蓄电池的正负极。
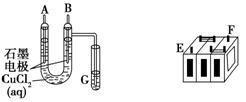
(1)若A接E,B接F,而B电极出现________,反应式为________,则说明F为正极;
(2)若铅蓄电池工作时(放电),其E所在电极的电极反应式为:________,充电时该极与外加电源的________极相连。
(3)若用该电池电解Cu(NO3)2 溶液,其电解方程式为 ________
若有0.2mol电子发生转移,则正极消耗的PbO2的物质的量是________ ;要想CuSO4溶液恢复原样,需加入的物质是________,质量为________
-
已知吡啶( )与苯环性质相似。有机物M与磷酸在一定条件下形成磷酸吡醛,
)与苯环性质相似。有机物M与磷酸在一定条件下形成磷酸吡醛,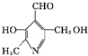 (M)+H3PO4
(M)+H3PO4 H2O+
H2O+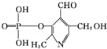 (磷酸吡醛),磷酸吡醛是细胞的重要组成部分.下列说法不正确的是( )
(磷酸吡醛),磷酸吡醛是细胞的重要组成部分.下列说法不正确的是( )
A.M能使酸性高锰酸钾溶液褪色
B.1 mol M能与金属钠反应,消耗2 mol Na
C.1 mol磷酸吡醛与NaOH溶液反应,最多消耗3 mol NaOH
D.M与足量H2反应后所得有机物的分子式为C8H17O3N
-
次磷酸(H3PO2)是一种精细磷化工产品,属于一元弱酸,具有较强的还原性。下列有关说法正确的是
A.用惰性电极电解NaH2PO2溶液,其阳极反应式为:2H2O-4e-=O2↑+4H+
B.H3PO2与过量NaOH溶液反应的离子方程式为:H3PO2+3OH-=PO23-+3H2O
C.将H3PO2溶液加入到酸性重铬酸钾溶液中,H3PO2的还原产物可能为H3PO4
D.H3PO2溶于水的电离方程式为H3PO2 H++H2PO2-
H++H2PO2-
-
次磷酸(H3PO2)是一种具有强还原性的一元弱酸,工业上常利用H3PO2和AgNO3溶液反应进行化学镀银,已知该反应中氧化剂与还原剂的物质的量之比为4:1,则下列说法中不正确的是( )
A. H3PO2中磷元素的化合价为+1 B. H3PO2的电离方程式为H3PO2 H++H2PO2-
H++H2PO2-
C. H3PO2被AgNO3氧化成了H3PO4 D. NaH2PO2、NaH2PO4、Na2HPO4均为酸式盐
-
次磷酸(H3PO2)是一种精细磷化工产品,属于一元弱酸,具有较强的还原性。下列有关说法正确的是
A.H3PO2溶于水的电离方程式为:H3PO2 3H++PO23-
3H++PO23-
B.H3PO2与过量NaOH溶液反应的离子方程式为:H3PO2+3OH-=PO23-+3H2O
C.将H3PO2溶液加入到酸性高锰酸钾溶液中,H3PO2的氧化产物为H3PO4
D.用惰性电极电解NaH2PO2溶液,其阳极反应式为:H2PO2-4e-+2H2O =O2↑+4H+
 ,二元中强酸)均是重要的精细化工产品。
,二元中强酸)均是重要的精细化工产品。Cr3+
Cr(OH)3。常温下,要使Cr3+沉淀完全,溶液的pH应调至________。(已知Cr(OH)3的Ksp=10-32)


 (M)+H3PO4
(M)+H3PO4 (磷酸吡醛),磷酸吡醛是细胞的重要组成部分.下列说法不正确的是( )
(磷酸吡醛),磷酸吡醛是细胞的重要组成部分.下列说法不正确的是( )