-
用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A.含有NA个氦原子的氦气在标准状况下的体积约为11.2 L
B.25 ℃,1.01×105 Pa,32 g O2和O3的混合气体所含原子数为2.5NA
C.标准状况下,11.2 L H2O含有的原子数为1.5NA
D.常温常压下,44 g CO2含有的原子数为3NA
难度: 简单查看答案及解析
-
下列除杂方案错误的是( )
选项
被提纯的物质
杂质
除杂试剂
A
FeCl3(aq)
Fe2+
通Cl2
B
AlCl3(aq)
Cu2+
Al粉
C
NaHCO3(aq)
Na2CO3
CO2气体
D
FeCl3(aq)
Cu2+
Fe粉
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
下列材料中所涉及的合金不属于新型合金的是( )
A.
 飞机窝扇用的是耐高温的合金材料
飞机窝扇用的是耐高温的合金材料B.
 蛟龙号载人舱是用钛合金制的
蛟龙号载人舱是用钛合金制的C.
 不锈钢盆
不锈钢盆D.
 新能源汽车储氢材料
新能源汽车储氢材料难度: 简单查看答案及解析
-
下列关于硫酸的分类不正确的是( )
A.含氧酸 B.无氧酸 C.强酸 D.二元酸
难度: 简单查看答案及解析
-
下列微粒结构示意图中,不正确的是( )
A.
B.
C.
D.
难度: 简单查看答案及解析
-
考古学上常用
来测定文物的年代。
的原子核内中子数是( )
A.8 B.10 C.14 D.20
难度: 简单查看答案及解析
-
下列关于氧化钠与过氧化钠的说法正确的是( )
A.它们属于碱性氧化物
B.它们都能与水反应产生氧气
C.它们都能与二氧化碳发生氧化还原反应
D.过氧化钠是潜水艇和呼吸面具的供氧剂
难度: 简单查看答案及解析
-
下列生活中的物质与其有效成分的化学式、用途的对应关系中,不正确的是( )
选项
A
B
C
D
生活中的物质
84消毒液
小苏打
复方氢氧化铝片
食盐
有效成分的化学式
Ca(OH)2
NaHCO3
Al(OH)3
NaCl
用途
做消毒剂
做发酵粉
做抗酸药
做调味品
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
下列下列关于F、Cl、Br、I的比较,不正确的是( )
A.单质的氧化性随核电荷数的增加而减弱
B.单质的颜色随核电荷数的增加而加深
C.它们的氢化物的稳定性随核电荷数的增加而增强
D.它们的原子核外电子层数随核电荷数的增加而增多
难度: 简单查看答案及解析
-
下列各组粒子中属于同位素的是( )
A.C60与C120 B.
、D、T C.H2O、D2O、T2O D.H-、H+、H
难度: 简单查看答案及解析
-
下列各组中的离子,能在溶液中大量共存的是( )
A.Fe3+、Cu2+、Cl-、SO42- B.Fe2+、H+、Cl-、MnO4-
C.H+、ClO-、Cl-、SO42- D.K+、Fe3+、SO42-、OH-
难度: 中等查看答案及解析
-
下列各图示中能较长时间看到Fe(OH)2白色沉淀的是
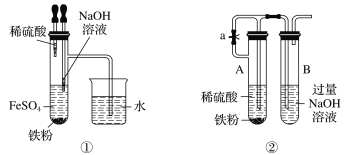
A.①②③ B.①②④ C.①②③④ D.②③④
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是( )
A.铁与盐酸反应:Fe+2H+=Fe3++H2↑
B.氯气与水反应:Cl2+H2O=2H++Cl-+ClO-
C.将氧化铁与稀硫酸混合:Fe2O3+2H+=H2O+Fe3+
D.将氧化铝与氢氧化钠溶液混合:Al2O3+2OH-=H2O+2AlO2-
难度: 中等查看答案及解析
-
下列叙述正确的是( )
A.氯气的性质很活泼,它与氢气混合后立即发生爆炸
B.实验室制取氯气时,为了防止污染环境,多余的氯气可以用氢氧化钙溶液吸收
C.新制氯水的漂白性强于久置氯水的漂白性
D.检验HCl气体中是否混有Cl2的方法是将气体通入硝酸银溶液
难度: 中等查看答案及解析
-
下列实验过程不可以达到实验目的的是( )
编号
实验目的
实验过程
A
探究维生素C的还原性
向盛有2 mL黄色氯化铁溶液的试管中滴加浓的维生素C溶液,观察颜色变化
B
比较金属镁和铝的活泼性
分別向两只盛有等体积等浓度的稀硫酸烧杯中加入打磨过的同样大小的镁片和铝片,比较反应现象
C
比较Fe3+和I2的氧化性强弱
向淀粉碘化钾溶液中滴入氯化铁溶液,溶液变蓝色
D
检验NaHCO3 与Na2CO3 溶液
用小试管分别取少量溶液,然后滴加澄清石灰水
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
某原子X的核内中子数为N,质量数为A,它与原子3H构成3HaX分子。b g 3HaX所含质子的物质的量是( )
A.
mol B.
mol
C.
mol D.
mol
难度: 中等查看答案及解析
-
如图装置用来检验氯气的部分性质,下列说法不正确的是( )
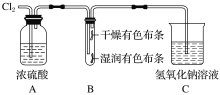
A.装置A的作用是除去氯气中的水蒸气
B.该实验必须在通风橱中进行
C.装置B的现象是两种布条都褪色
D.装置C中发生的反应为Cl2+2NaOH=NaCl+NaClO+H2O
难度: 中等查看答案及解析
-
高铁酸钠(Na2FeO4)是一种新型绿色消毒剂,主要用于饮用水处理。工业上制备高铁酸钠有多种方法,其中一种方法的化学原理可用离子方程式表示为: 3ClO-+2Fe3++10OH-=2FeO42-+3Cl-+5H2O,下列有关说法正确的是( )
A.ClO-是氧化剂、OH-是还原剂 B.Fe3+是还原剂、FeO42-是还原产物
C.生成2molFeO42-转移6NA个电子 D.ClO-的还原性大于FeO42-
难度: 中等查看答案及解析
-
将3g两种金属混合物的粉末与足量的盐酸反应,反应完全后,得到标准状况下的氢气3.36 L。则这两种金属不可能是( )
A.Al和Fe B.Ag和Al C.Mg和Al D.Zn和Cu
难度: 中等查看答案及解析
-
某溶液中仅含有Na+、Mg2+、SO42-、Cl-四种离子(不考虑水电离出的H+和OH-),其物质的量浓度之比为c(Na+)∶c(Mg2+)∶c(Cl-)=5∶7∶7。若c(Na+)为5 mol/L,则c(SO42-)为( )。
A.5 mol/L B.6mol/L C.7mol/L D.8mol/L
难度: 简单查看答案及解析