-
已知元素X、Y的核电荷数分别是a和b,它们的离子Xm+和Yn-的核外电子排布相同,则下列关系式正确的是( )
A.a=b+m+n B.a=b-m+n
C.a=b+m-n D.a=b-m-n
难度: 简单查看答案及解析
-
关于化学键的下列叙述中正确的是( ).
A.离子化合物可能含共价键 B.共价化合物可能含离子键
C.离子化合物中只含离子键 D.离子化合物不能含共价键
难度: 简单查看答案及解析
-
.下列各组微粒中,核外电子总数相等的是( )
A.K+和Na+ B.CO2和NO2
C.CO和CO2 D.N2和CO
难度: 简单查看答案及解析
-
下列表示物质结构的化学用语或模型图正确的是( )
A.氯化铵(NH4Cl)的电子式:
B.H2O2的电子式:
C.HClO的结构式:H-O-Cl
D.14C的原子结构示意图:
难度: 简单查看答案及解析
-
关于元素周期表,下列叙述中不正确的是( )
A.在金属元素与非金属元素的分界线附近可以寻找制备半导体材料的元素
B.在过渡元素中可以寻找制备催化剂及耐高温和耐腐蚀的元素
C.在非金属元素区域可以寻找制备新型农药材料的元素
D.在地球上元素的含量的分布和它们在元素周期表中的位置有密切关系
难度: 简单查看答案及解析
-
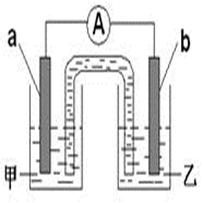
工业上常将铬镀在其他金属表面,同铁、镍组成各种性质的不锈钢,在下图装置中,观察到图1装置铜电极上产生大量的无色气泡,而图2装置中铜电极上无气体产生,铬电极上产生大量有色气体,则下列叙述正确的是( )

A.图1为原电池装置,Cu电极上产生的是O2
B.图2装置中Cu电极上发生的电极反应式为:Cu-2e-= Cu2+
C.由实验现象可知:金属活动性Cu>Cr
D.两个装置中,电子均由Cr电极流向Cu电极
难度: 简单查看答案及解析
-
将4 mol A气体和2 mol B气体在2L的密闭容器中混合并在一定条件下发生反应:
2A(g)+B(g)
2C(g),2 s时测得C的浓度为0.6mol·L-1。下列说法正确的是( )
A.用物质A表示的平均反应速率为0.3mol/(L·s);
B.用物质B表示的平均反应速率为0.6mol/(L·s);
C.2 s时物质A的转化率为70%;
D.2 s时物质B的浓度为0.7mol·L-1
难度: 简单查看答案及解析
-
元素在周期表中的位置,反映了元素的原子结构和元素的性质,下列说法正确的是( )
A.同一元素的单质,不可能既能与酸反应,又能与碱反应
B.第三周期元素的最高正化合价等于它所处的主族序数
C.短周期元素形成离子后,最外层电子都达到8电子稳定结构
D.同一主族元素的原子,最外层电子数相同,化学性质完全相同
难度: 简单查看答案及解析
-
下列有关物质性质的比较中,正确的是
A.热稳定性:CH4>NH3>H2O B.还原性:
<
<
C.酸性:H3PO4>H2SO4>HClO4 D.原子半径:Na>Mg>O
难度: 简单查看答案及解析
-
某元素只存在两种天然同位素,且在自然界它们的含量相近,其相对原子质量为152.0,原子核外的电子数为63。下列叙述中错误的是( )
A.它是副族元素
B.它是第六周期元素
C.它的原子核内有63个质子
D.它的一种同位素的核内有89个中子
难度: 简单查看答案及解析
-
一定温度下在容积恒定的密闭容器中,进行如下可逆反应:A(s)+2B(g)
C(g)+D(g),当下列物理量不发生变化时,能表明该反应一定达到平衡状态的是( )
A.A的物质的量浓度 B.混合气体的总物质的量
C.容器内气体的压强 D.混合气体的密度
难度: 简单查看答案及解析
-
下图为番茄电池,下列说法正确的是( )
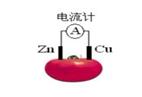
A.一段时间后,锌片质量会变小 B.铜电极是该电池的负极
C.电子由铜通过导线流向锌 D.锌电极是该电池的正极
难度: 简单查看答案及解析
-
A、B、C均为短周期元素,它们在周期表中的位置如右下图。已知B、C两元素在周期表中族序数之和是A元素族序数的2倍;B、C元素的原子序数之和是A元素原子序数的4倍,则A、B、C分别是( )
A.Be Na Al B.B Mg Si
C.O P Cl D.C Al P
难度: 简单查看答案及解析
-
下列装置中能够形成原电池的是( )
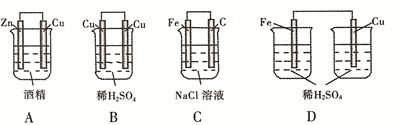
难度: 简单查看答案及解析
-
短周期元素X、Y、Z、W的原子序数依次增大,X 原子的最外层电子数是其内层电子总数的3 倍,Y 原子的最外层只有2 个电子,Z 单质可制成半导体材料,W与X属于同一主族。下列叙述正确的是( )
A.元素X 的简单氢化物的沸点比W 的氢化物的沸点低
B.元素Y 的最高价氧化物对应水化物的为强碱
C.化合物YX、ZX2、WX2中化学键的类型相同
D.原子半径的大小顺序: rY >rZ >rW >rX
难度: 简单查看答案及解析
-
对A2+3B2
2AB3的反应,以下反应速率的表示中,速率最快的是( )
A.v(AB3)=0.5mol/(L·min)
B.v(B2)=0.6mol/(L·min)
C.v(A2)=0.4mol/(L·min)
D.v(A2)=0.3mol/(L·min)"
难度: 简单查看答案及解析
-
下列事实不能用电化学理论解释的是( )
A.镀层被划破后,镀锌的铁制品比镀锡的铁制品耐腐蚀
B.轮船水线以下的船壳上镶嵌有一定量的锌块
C.铝片不用特殊方法保存
D.锌跟稀硫酸反应时,滴入少量硫酸铜溶液后反应速率加快
难度: 简单查看答案及解析
-
我国科学家在世界上首次合成了三种新核素,其中一种新核素的名称是铪-185,符号185Hf,下列关于铪-185的叙述,不正确的是( )
A.它是一种新的原子
B.它是一种新的元素
C.它的质量数为185
D.它是铪-180的一种新的同位素
难度: 简单查看答案及解析
-
为探究原电池的形成条件和反应原理,某同学设计了如下实验并记录了现象:
①向一定浓度的稀硫酸中插入锌片,看到有气泡生成;
②向上述稀硫酸中插入铜片,没有看到有气泡生成;
③将锌片与铜片上端接触并捏住,一起插入稀硫酸中,看到铜片上有气泡生成,且生成气泡的速率比实验①中快;
④在锌片和铜片中间接上电流计,再将锌片和铜片插入稀硫酸中,发现电流计指针偏转。
下列关于以上实验设计及现象的分析,不正确的是( )
A.实验①、②说明锌能与稀硫酸反应而铜不能
B.实验③说明发生原电池反应时会加快化学反应速率
C.实验③说明在该条件下铜可以与稀硫酸反应生成氢气
D.实验④说明该原电池中铜为正极、锌为负极
难度: 简单查看答案及解析
-
下列分子中有3个原子核的是( )
A.HF B.NH3
C.H2O D.CH4
难度: 简单查看答案及解析