-
下列说法中正确的是( )
A. 同一原子中,1s、2s、3s电子的能量逐渐减小
B. 3p2表示3p能级有两个轨道
C. 处于最低能量状态的原子叫做基态原子
D. 同一原子中,2p、3p、4p能级的轨道数依次增多
难度: 中等查看答案及解析
-
下列说法中,正确的是
A. H35Cl、H37Cl属于同素异形体
B. 16O与 18O的中子数不同,核外电子排布相同
C. 稳定性:CH4>SiH4;还原性:HCl>H2S
D. K+、Ca2+、Mg2+的离子半径依次增大,还原性依次增强
难度: 中等查看答案及解析
-
在多电子原子中,决定轨道能量的是
A. 能层 B. 能层和能级
C. 能层、能级和原子轨道空间分布 D. 原子轨道空间分布和电子自旋方向
难度: 简单查看答案及解析
-
下列表示不正确的是
A. KOH的电子式:
B. 二氧化碳的结构式:O=C=O
C. CH4的球棍模型:

D. S2ˉ的离子结构示意图:
难度: 简单查看答案及解析
-
下列各组分子中,都属于含极性键的非极性分子的是
A.CO2 H2S B.C2H4 BF3 C.C60 C2H4 D.NH3 HCl
难度: 简单查看答案及解析
-
下列说法中正确的是
A. 焰色反应是化学变化
B. 基态碳原子的电子排布式是1s22s12p3
C. 焰色反应是金属原子的电子从基态跃迁到激发态时产生的光谱
D. 同一原子处于激发态时的能量一定大于其处于基态时的能量
难度: 简单查看答案及解析
-
下列有关晶体的叙述中,不正确的是
A. 氯化钠和氯化铯晶体中,阳离子的配位数均为6
B. 金刚石为三维网状结构,由碳原子以sp3杂化轨道形成共价键
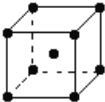
C. 金属钠的晶体采用体心立方堆积,每个晶胞含2个原子,配位数为8
D. 干冰晶体中,每个CO2分子周围紧邻12个CO2分子
难度: 简单查看答案及解析
-
下列现象不能用“相似相溶”解释的是
A. 二氧化硫易溶于水 B. 用CCl4 萃取碘水中的碘
C. 氯气易溶于NaOH溶液 D. 苯与水混合静置后分层
难度: 简单查看答案及解析
-
下列关于金属铬的叙述中不正确的是( )
A. 铬元素在周期表中处于第四周期VIB族
B. 铬原子的外围电子层排布为3d44s2
C. 铬原子中,质子数为24
D. 铬元素位于元素周期表的d区,是过渡元素
难度: 简单查看答案及解析
-
下列描述中正确的是
A. CS2为直线形的极性分子
B. NH4+中N-H键能、键长和键角均相同
C. AB2为V形,则A一定为sp2杂化
D. SiF4和SO32-的中心原子均为sp2杂化
难度: 中等查看答案及解析
-
下列现象中,能用范德华力解释的是
A. 氮气的化学性质稳定 B. 通常状况下,溴呈液态,碘呈固态
C. 水的沸点比硫化氢高 D. 锂的熔点比钠高
难度: 中等查看答案及解析
-
下列说法正确的是
A. 原子核外电子排布式为1s2的原子与原子核外电子排布式为1s22s2的原子化学性质相似
B. Fe3+的最外层电子排布式为3s23p63d5
C. 基态铜原子的最外层的电子排布图:
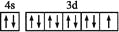
D. 所有非金属元素都分布在p区
难度: 中等查看答案及解析
-
某元素原子的价电子构型是3s23p4,则它在周期表中的位置是
A. 第四周期ⅡA族 B. 第三周期ⅣA族
C. 第三周期ⅥA族 D. 第二周期ⅣA族
难度: 中等查看答案及解析
-
下列说法中错误的是
A. 根据对角线规则,铍和铝的性质具有相似性
B. [Cu(H2O)4]2+中Cu提供空轨道,H2O中O提供孤对电子形成配位键
C. 元素电负性越大的原子,吸引电子的能力越强
D. 手性分子互为镜像,它们的性质没有区别
难度: 中等查看答案及解析
-
原子序数依次增大的四种短周期主族元素A、B、C、D,A元素的一种同位素原子核内无中子;B元素形成的化合物种类最多;C、D元素同主族且最外层电子数为偶数。下列叙述正确的是
A. A元素的各同位素形成的双原子分子A2最多有3种
B. 化合物BC2的电子式为
C. B、C、D三种元素的非金属性强弱顺序为C>D>B
D. 化合物A2C的沸点高于A2D是因为C—A键比D—A键稳定
难度: 中等查看答案及解析
-
元素周期律揭示了元素间的递变规律,下列递变规律正确的是( )
A. ⅣA族元素氢化物沸点:SiH4>CH4,所以ⅤA族元素氢化物沸点:PH3>NH3
B. 第二周期元素氢化物稳定性:HF>H2O,所以第三周期元素氢化物稳定性:HCl>H2S
C. ⅦA族元素的非金属性:F>Cl,所以ⅦA族元素氢化物的酸性:HF<HCl
D. 镁比铝活泼,工业上用电解熔融氧化铝制铝,所以工业上也用电解熔融氧化镁制镁
难度: 简单查看答案及解析
-
碳纳米管是由碳原子组成的六角形蜂巢状平面薄膜卷曲而成,具有许多异常的力学、电学和化学性能。

下列关于碳纳米管的说法不正确的是
A. 碳纳米管属于一种有机合成纤维
B. 碳纳米管与金刚石互为同素异形体
C. 常温下,碳纳米管具有较好的稳定性
D. 碳纳米管比表面积大,可用作新型储氢材料
难度: 中等查看答案及解析
-
下表所列物质晶体的类型全部正确的一组是
原子晶体
离子晶体
分子晶体
A
氮化硅
磷酸
单质硫
B
单晶硅
氯化铝
白磷
C
金刚石
烧碱
冰
D
铁
尿素
冰醋酸
难度: 中等查看答案及解析
-
关于下列几种离子晶体,说法不正确的是( )
A. 由于NaCl晶体和CsCl晶体中正负离子半径比不相等,所以两晶体中离子的配位数不相等
B. CaF2晶体中,Ca2+配位数为8,F-配位数为4,配位数不相等主要是由于F-、Ca2+电荷(绝对值)不相同
C. MgO的熔点比MgCl2高,主要是因为MgO的晶格能比MgCl2大
D. MCO3中M2+半径越大,MCO3热分解温度越低
难度: 中等查看答案及解析
-
X、Y、Z、M为4种短周期元素,X、Y位于同周期且原子半径r(X)>r(Y), Y2-与M+的电子层结构相同,Z与X的原子核外最外层电子数相同,Z的单质可制成半导体材料。下列说法不正确的是
A.X的氢化物X2H2分子中含有2个σ键和3个π键
B.XY2、ZY2、M2Y的晶体分别属于3种不同类型的晶体
C.单质M的晶体是体心立方堆积,M的配位数是8
D.由元素X与Z形成的化合物中只含共价键
难度: 中等查看答案及解析
-
关于原子轨道的说法正确的是
A. 凡是中心原子采取sp3杂化轨道成键的分子立体构型都是正四面体
B. CH4中的sp3杂化轨道是4个H原子的1s 轨道和C原子的2p轨道混合形成
C. sp3杂化轨道是由同一原子中能量相近的s 和p轨道混合形成的一组新轨道
D. 凡AB3型的共价化合物,中心原子A均采用sp3杂化轨道成键
难度: 中等查看答案及解析
-
两种元素X、Y,其原子核外电子层数分别为a、b,最外层电子数分别为m、n。下列说法错误的是
A. 若8>m>3,则X必定为主族元素
B. 若a<b<m=n=4,则晶体类型相同时,其单质熔点:Y>X
C. 若Y的气态氢化物化学式为YHn,且b<4,则该氢化物为非极性分子
D. 若a=b=3,8>m>n>b,则元素非金属性:X>Y
难度: 中等查看答案及解析
-
关于氢键,下列说法正确的是
A.由于冰中的水分子间存在氢键,所以其密度大于液态水
B.可以用氢键解释接近沸点的水蒸气的相对分子质量测定值比用化学式(H2O)计算出来的相对分子质量大
C.分子间氢键和分子内氢键都会使熔沸点升高
D.水加热到很高的温度都难以分解,这是由于氢键所致
难度: 中等查看答案及解析
-
如图所示是氯化铯晶体的晶胞(晶体中最小的重复结构单元),已知晶体中2个最近的Cs+离子核间距为a cm,氯化铯(CsCl)的相对分子质量为M,NA为阿伏加德罗常数,则氯化铯晶体的密度为
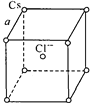
A.
g/cm3 B.
g/cm3 C.
g/cm3 D.
g/cm3
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.CS2是极性键构成的极性分子
B.SO2与CO2为等电子体
C.金属晶体的六方最密堆积和面心立方最密堆积的方式空间利用率最高
D.1molNaHSO4熔融态时有3mol离子
难度: 中等查看答案及解析
-
二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂;其分子结构中每个原子均满足8电子结构。常温下,S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体。下列说法中错误的是
A. S2Cl2中的硫元素显+1价
B. S2Cl2结构中的化学键只含有极性键
C. S2Br2与S2Cl2结构相似,熔沸点:S2Br2>S2Cl2
D. S2Cl2与H2O反应的生成物中可能有S
难度: 中等查看答案及解析
-
已知C3N4晶体具有比金刚石还大的硬度,且构成该晶体的微粒间只以单键结合。下列关于C3N4晶体的说法错误的是
A.该晶体属于原子晶体,其熔、沸点很高
B.该晶体中每个碳原子上连有4个氮原子,每个氮原子连接3个碳原子
C.该晶体中碳原子和氮原子都满足最外层8电子结构
D.该晶体的结构与金刚石类似,都是原子间以非极性键形成的空间网状结构
答
难度: 中等查看答案及解析
-
下列分子中,中心原子的杂化轨道类型相同,空间构型也相同的是
A.BeCl2 CO2 B.H2O SO2 C.BF3 NCl3 D.SiCl4 SO3
难度: 中等查看答案及解析
-
下列晶体中,化学键种类相同,晶体类型也相同的是
A.SO2与SiO2 B.CO2与H2O C.NaCl与HCl D.CCl4与KCl
难度: 中等查看答案及解析
-
四种短周期主族元素W、X、Y、Z的原子序数依次增大,W、X的简单离子具有相同电子层结构,X的原子半径是短周期主族元素原子中最大的, W与Y同族,Z与X形成的离子化合物的水溶液呈中性。下列说法正确的是
A. 简单离子半径:W<X<Z B. W与X形成的化合物溶于水后溶液呈碱性
C. 气态氢化物的沸点:W<Y D. 最高价氧化物的水化物的酸性:Y>Z
难度: 中等查看答案及解析
-
下列说法正确的是
A.硝酸钾和冰的熔化需克服相同类型的作用力
B.氢化物HA的沸点比HB高,是因为1molHA分子中的H-A键断裂时吸收的能量比1molHB分子中键断裂吸收的能量多
C.离子晶体在熔融状态下能导电是因为晶体受热时离子键被削弱,形成了自由移动的离子
D.非金属元素间只能形成共价化合物,金属和非金属元素间形成离子化合物
难度: 中等查看答案及解析
-
下列说法中正确的是( )
A.SO2、CO2、SiO2中的S、C、Si均为sp3杂化
B.H3O+、NH4+、[Cu(NH3)4]2+均含有配位键
C.SO32—、CO32—、SiO32—均为平面三角形
D.石墨、新型高分子导电材料、聚乙烯、金属晶体均含有金属键
难度: 中等查看答案及解析
-
某离子晶体的晶胞结构如下图所示:
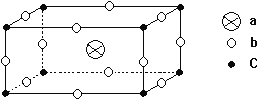
则该离子晶体的化学式为
A. abc B. abc3 C. ab2c3 D. ab3c
难度: 简单查看答案及解析
-
下列说法正确的是
A. 碘单质的升华过程中不存在化学键破坏的过程
B. NaCl溶于水后,因为共价键被破坏,从而形成了Na+和Cl-
C. 在N2、CO2和SiO2物质中,都存在共价键,它们都是由分子构成
D. H2S分子中,所有原子的最外层都达到了8电子的稳定结构
难度: 中等查看答案及解析
-
关于化学式为[TiCl(H2O)5]Cl2·H2O的配合物的下列说法中正确的是
A.配位体是Cl-和H2O,配位数是9
B.中心离子是Ti3+,形成配位键时提供电子对
C.配离子是[TiCl(H2O)5]2+,内界和外界中的Cl-的数目比是1∶2
D.向含1 mol该配合物的水溶液中加入足量AgNO3溶液,生成AgCl沉淀3 mol
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是
A.124 g P4含有P—P键的个数为4NA
B.12 g石墨烯(单层石墨)中含有C-C键的数目为3NA
C.60gSiO2中含Si—O键的个数为2NA
D. 六方最密堆积的配位数是12,空间利用率是74%
难度: 中等查看答案及解析
-
下列各种叙述中正确的是
A. 在CH2=CH2分子中,存在4个σ键和一个π键
B. 在共价化合物中,一定存在极性键,可能存在非极性键,一定不存在离子键
C. N、O、F电负性大小:F>O>N;第一电离能大小:F>O>N
D. 酸性强弱:H2SO4>H2SO3>H2SeO3;岩浆晶出的先后顺序:SiO2、MgSiO3、CaSiO3
难度: 中等查看答案及解析
-
己知元素X、Y同周期,且电负性X>Y,下列说法中一定不正确的是
A. 第一电离能:Y<X
B. 最简单气态氢化物的稳定性: HmY> HnX
C. 最高价含氧酸的酸性:元素X对应酸的酸性强于Y
D. X和Y形成的化合物中,X显负价,Y显正价
难度: 简单查看答案及解析
-
北京大学和中国科学院的化学工作者己成功研制出碱金属与C60形成的球碳盐K3C60,实验测知该物质属于离子晶体,具有良好的超导性。下列关于K3C60的组成和结构分析正确的是( )
A. K3C60中既有离子键,又有极性键
B. lmol K3C60中含有的离子数目为63×6.02×1023
C. 该晶体在熔融状态下能导电
D. 该物质的化学式可写为KC20
难度: 中等查看答案及解析
-
下面的排序不正确的是
A.晶体熔点由低到高:CF4<CCl4<CBr4<CI4
B.硬度由大到小:金刚石>碳化硅>晶体硅
C.晶格能由大到小:NaF> NaCl> NaBr>NaI
D.熔点由高到低:Na>Mg>Al
难度: 中等查看答案及解析
-
德国重离子研究中心2010年2月19日宣布,由该中心人工合成的第ll2号化学元素从即日起获正式名称“Copemicium”,相应的元素符号为“Cn”。该元素的名称是为了纪念著名天文学家哥白尼而得名。该中心人工合成Cn的过程可表示为:7030Zn+20882Pb→277112Cn+10n。下列叙述中正确的是 ( )
A. 上述合成过程属于化学变化
B. Cn元素位于元素周期表的第七周期,是副族元素
C. Cn元素的相对原子质量为277
D. 277112Cn的原子核内质子数比中子数多53
难度: 中等查看答案及解析
-
已知X、Y是主族元素,I为电离能,单位是kJ•mol-1。根据下表所列数据判断错误的是
电离能
元素
I1
I2
I3
I4
X
496
4562
6912
9543
Y
578
1817
2745
11600
A. 元素X的常见化合价是+1价
B. 元素Y是ⅢA族的元素
C. 元素X与氧形成化合物时,化学式可能是X2O2
D. 若元素Y处于第三周期,则它可与冷水剧烈反应
难度: 中等查看答案及解析
-
下列关于晶体的说法正确的组合是 ( )
①分子晶体中都存在共价键
②在晶体中只要有阳离子就一定有阴离子
③金刚石、SiC、NaF、NaCl、H2O、H2S晶体的熔点依次降低
④离子晶体中只有离子键没有共价键,分子晶体中肯定没有离子键
⑤CaTiO3晶体中(晶胞结构如图所示),已知Ca2+、O2—、Ti4+分别位于立方体的体心、面心和顶点,则每个Ti4+和12个O2—相紧邻

⑥SiO2晶体中每个硅原子与两个氧原子以共价键相结合
⑦晶体中分子间作用力越大,分子越稳定
⑧氯化钠熔化时离子键被破坏
A.①②③⑥ B.①②④ C.③⑤⑦ D.③⑤⑧
难度: 困难查看答案及解析
-
下列说法正确的是:( )
①Cl-的结构示意图

②羟基的电子式:

③HClO的结构式:H—Cl—O
④NaHCO3在水中的电离方程式:NaHCO3=Na++H++CO32-
⑤Na2O的水溶液能导电,这不能说明Na2O是电解质
⑥SiO2既能与氢氟酸反应又能与NaOH溶液反应,故SiO2是两性氧化物;
⑦分馏、干馏、裂化都是化学变化( )
A. ①②⑤ B. ①④⑥⑦ C. ②③④⑥ D. ②③⑤⑥⑦
难度: 简单查看答案及解析