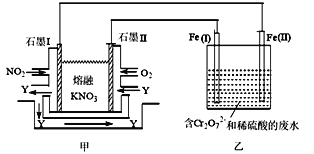
-
中华文化源远流长、博大精深。下列有关蕴含的化学知识的说法中,不正确的是( )
A.食品包装中常见的抗氧化剂成分为:还原性铁粉、氯化钠、炭粉等,其脱氧原理与钢铁的吸氧腐蚀相同
B.“陶尽门前土,屋上无片瓦。十指不沾泥,鳞鳞居大厦。”黏土烧制陶瓷的过程发生了化学变化
C.“兰陵美酒郁金香,玉碗盛来琥珀光。”粮食发酵产生的酒精分散在酒糟中,可以通过萃取分液与酒糟分离
D.侯氏制碱法中的“碱”指的是纯碱
难度: 简单查看答案及解析
-
NA代表阿伏加德罗常数的值。下列说法正确的是( )
A.标准状况下,11.2 L Cl2溶于水,溶液中Cl-,ClO-和HClO的微粒数之和为NA
B.32.5 g FeCl3水解形成的Fe(OH)3胶体粒子数为0.2NA
C.1 mol PC13与1 mol 36C12反应达到平衡时,产物中含P—36C1键数目为2NA
D.反应
+
→
+
中,每生成294g
释放的中子数为3NA
难度: 中等查看答案及解析
-
某有机物结构简式如图:
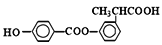
下列关于该有机物的说法正确的是( )
①分子式为C16H14O5;
②能使酸性KMnO4溶液褪色;
③能发生加成反应和取代反应;
④苯环上的一溴代物有4种;
⑤1 mol该有机物水解时最多能消耗4 mol NaOH;
⑥1 mol该有机物在一定条件下和H2反应,共消耗6 mol H2。
A.①②⑤ B.①②③⑤⑥ C.①④⑤⑥ D.①②④⑤⑥
难度: 中等查看答案及解析
-
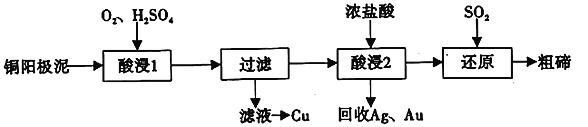
CuSO4是一种重要的化工原料,其制备途径及性质如图所示(假设恰好完全反应)。下列说法正确的是
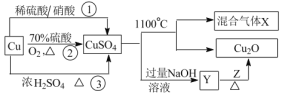
A.途径①所用混酸中,H2SO4与 HNO3物质的量之比为2:3
B.1molCuSO4在 1100℃所得混合气体中,O2为 0.75mol
C.Z 只能是葡萄糖
D.相对于途径①、③,途径②更好地体现了绿色化学思想
难度: 困难查看答案及解析
-
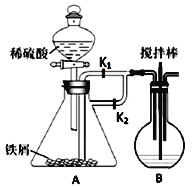
下列装置图的使用说法正确的是( )
A.
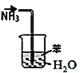 装置吸收NH3制氨水
装置吸收NH3制氨水B.
 装置不需添加其它仪器就能检验其气密性
装置不需添加其它仪器就能检验其气密性C.
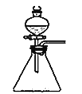 装置中,向石灰石中滴加硫酸溶液,制取二氧化碳
装置中,向石灰石中滴加硫酸溶液,制取二氧化碳D.
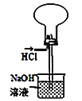 装置收集并吸收多余的HCl
装置收集并吸收多余的HCl难度: 中等查看答案及解析
-
下列叙述中不正确的是( )(已知Ksp(AgCl)=4.0×10-10,Ksp(AgBr)=4.9×10-13,Ksp(Ag2CrO4)=2.0×10-12)
A.0.l mol·L-1 NH4HS溶液中有:c(NH4+)+c(NH3·H2O)>c(HS-)+c(S2-)
B.将AgCl和AgBr的饱和溶液等体积混合,再加入足量的浓AgNO3溶液,AgCl沉淀质量大于AgBr沉淀
C.向浓度均为1×10-3 mol/L的KCl和K2CrO4混合液中滴加1×10-3 mol/L AgNO3溶液,先生成AgCl沉淀
D.常温下,pH=4.75、浓度均为0.l mol/L的CH3COOH、CH3COONa混合溶液:c(CH3COO-)+c(OH-) = c(CH3COOH)+c(H+)
难度: 中等查看答案及解析
-
常温时,1 mol·L-1的HClO2和1 mol·L-1的HMnO4两种酸溶液,起始时的体积均为V0,分别向两溶液中加水进行稀释,稀释后溶液体积为V,所得曲线如图所示。下列说法正确的是( )
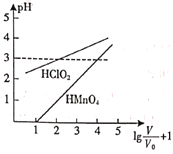
A.在0≤pH≤5时,HMnO4溶液满足pH=lg
+1
B.当稀释至pH均为3时,溶液中c(ClO2-)>c(MnO4-)
C.稀释前分别用1 mol·L-1的NaOH溶液中和,消耗的NaOH溶液体积:HMnO4>HClO2
D.当稀释至pH均为3时,HMnO4溶液中的V等于1000 V0
难度: 中等查看答案及解析