-
碲(52Te)被誉为“现代工业、国防与尖端技术的维生素”,工业上常用铜阳极泥(主要成分是Cu2Te,含Ag、Au等杂质)为原料提取碲并回收金属,其工艺流程如下:

已知:TeO2是两性氧化物,微溶于水,易溶于较浓的强酸和强碱。回答下列问题:
(1)碲在元素周期表中的位置_______________。
(2)“加压酸浸1”过程中将碲元素转化成TeO2,应控制溶液的pH为4.5~5.0,酸度不能过高,原因是___________________,其中“加压”的目的是_______________,写出“加压酸浸1”过程中Cu2Te发生反应的化学方程式__________________________。
(3) “酸浸2”时温度过高会使碲的浸出率降低,原因为______________________,要从Ag和Au中分离出Au,可以向回收的Ag和Au中加入的试剂是_______________。
(4)写出“还原”反应中发生的离子方程式_______________________。
(5)工业上另一种提取碲的方法是将铜阳极泥在空气中焙烧,使碲转化成TeO2,再加NaOH碱浸,以石墨为电极电解溶液获得Te。电解过程中阴极的电极反应式为______。
-
碲(52Te)被誉为“国防与尖端技术的维生素”。工业上常用铜阳极泥(主要成分是Cu2Te、含Ag、Au等杂质)为原料提取碲并回收金属,其工艺流程如下:
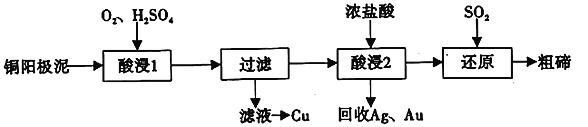
已知:TeO2微溶于水,易与较浓的强酸、强碱反应。回答下列问题:
(1)已知Te为VIA族元素,TeO2被浓NaOH溶液溶解,所生成盐的化学式为____________。
(2)“酸浸2”时温度过高会使Te的浸出率降低,原因是________________________。
(3)“酸浸1”过程中,控制溶液的酸度使Cu2Te转化为TeO2,反应的化学方程式为____________;
“还原”过程中,发生反应的离子方程式为_____________________________。
(4)工业上也可用电解法从铜阳极泥中提取碲,方法是:将铜阳极泥在空气中焙烧使碲转化为TeO2,再用NaOH溶液碱浸,以石墨为电极电解所得溶液获得Te。电解过程中阴极上发生反应的电极方程式为____________________。在阳极区溶液中检验出有TeO42-存在,生成TeO42-的原因是_____________________。
(5)常温下,向l mol·L-1 Na2TeO3溶液中滴加盐酸,当溶液pH=5时,c(TeO32-):c(H2TeO3)=__________。(已知:H2TeO3的Ka1=1.0×10-3 Ka2=2.0×10-8)
-
碲(52Te)被誉为“国防与尖端技术的维生素”。工业上常用铜阳极泥(主要成分是Cu2Te、含Ag、Au等杂质)为原料提取碲并回收金属,其工艺流程如下:

已知:TeO2微溶于水,易与较浓的强酸、强碱反应。回答下列问题:
(1)已知Te为VIA族元素,TeO2被浓NaOH溶液溶解,所生成盐的化学式为____________。
(2)“酸浸2”时温度过高会使Te的浸出率降低,原因是________________________。
(3)“酸浸1”过程中,控制溶液的酸度使Cu2Te转化为TeO2,反应的化学方程式为____________;
“还原”过程中,发生反应的离子方程式为_____________________________。
(4)工业上也可用电解法从铜阳极泥中提取碲,方法是:将铜阳极泥在空气中焙烧使碲转化为TeO2,再用NaOH溶液碱浸,以石墨为电极电解所得溶液获得Te。电解过程中阴极上发生反应的电极方程式为____________________。在阳极区溶液中检验出有TeO42-存在,生成TeO42-的原因是_____________________。
(5)常温下,向l mol·L-1 Na2TeO3溶液中滴加盐酸,当溶液pH=5时,c(TeO32-):c(H2TeO3)=__________。(已知:H2TeO3的Ka1=1.0×10-3 Ka2=2.0×10-8)
-
碲(52Te)被誉为“国防与尖端技术的维生素”。工业上常用铜阳极泥(主要成分是Cu2Te、含Ag、Au等杂质)为原料提取碲并回收金属,其工艺流程如图:
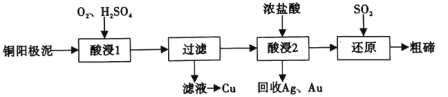
已知:TeO2微溶于水,易与较浓的强酸、强碱反应。回答下列问题:
(1)已知Te为VIA族元素,TeO2被浓NaOH溶液溶解,所生成盐的化学式为___。
(2)“酸浸1”过程中,为加快浸出速率,可采取的方法有___(填1种)。“酸浸2”时温度过高会使Te的浸出率降低,原因是___。
(3)“酸浸1”过程中,控制溶液的酸度使Cu2Te转化为TeO2,反应的化学方程式为___;“还原”过程中,发生反应的离子方程式为___。
(4)工业上也可用电解法从铜阳极泥中提取碲,方法是:将铜阳极泥在空气中焙烧使碲转化为TeO2,再用NaOH溶液碱浸,以石墨为电极电解所得溶液获得Te。电解过程中阴极上发生反应的电极方程式为___。在阳极区溶液中检验出有TeO42-存在,生成TeO42-的原因是___。
(5)常温下,向lmol·L-1 Na2TeO3溶液中滴加盐酸,当溶液pH=5时,c(TeO32-):c(H2TeO3)=___。(已知:H2TeO3的Ka1=1.0×10-3 Ka2=2.0×10-8)
-
碲(52Te)被誉为“国防与尖端技术的维生素”。工业上常用铜阳极泥(主要成分是Cu2Te、含Ag、Au等杂质)为原料提取碲并回收金属,其工艺流程如下:

已知:TeO2微溶于水,易与较浓的强酸、强碱反应。回答下列问题:
(1)已知Te为VIA族元素,TeO2被浓NaOH溶液溶解,所生成盐的化学式为____________。
(2)“酸浸2”时温度过高会使Te的浸出率降低,原因是________________________。
(3)“酸浸1”过程中,控制溶液的酸度使Cu2Te转化为TeO2,反应的化学方程式为____________;
“还原”过程中,发生反应的离子方程式为_____________________________。
(4)工业上也可用电解法从铜阳极泥中提取碲,方法是:将铜阳极泥在空气中焙烧使碲转化为TeO2,再用NaOH溶液碱浸,以石墨为电极电解所得溶液获得Te。电解过程中阴极上发生反应的电极方程式为____________________。在阳极区溶液中检验出有TeO42-存在,生成TeO42-的原因是_____________________。
(5)常温下,向l mol·L-1 Na2TeO3溶液中滴加盐酸,当溶液pH=5时,c(TeO32-):c(H2TeO3)=__________。(已知:H2TeO3的Ka1=1.0×10-3 Ka2=2.0×10-8)
-
碲被誉为“现代工业、国防与尖端技术的维生素”,工业上常用铜阳极泥(主要成分是Cu2Te,含Ag、Au等杂质)为原料提取碲并回收金属其工艺流程如下:
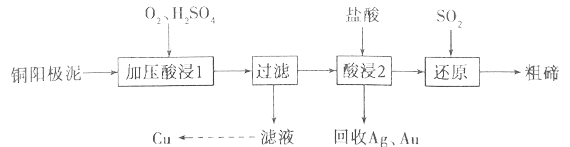
已知:TeO2是两性氧化物,微溶于水,易溶于较浓的强酸和强碱。回答下列问题:
(1)“加压酸浸1”过程中将碲元素转化成TeO2,应控制溶液的pH为4.5~5.0,酸度不能过高,原因是__________________________,其中“加压”的目的是______________________。写出“加压酸浸1”过程中Cu2Te发生反应的化学方程式_________________________________。
(2)“酸浸2”时温度过高会使碲的浸出率降低,原因为______________________。要从Ag和Au中分离出Au,可以向回收的Ag和Au中加入的试剂是______________________。
(3)写出“还原”反应中发生的离子方程式_________________________________。
(4)工业上另一种提取碲的方法是将铜阳极泥在空气中焙烧,使碲转化成TeO2,再加NaOH碱浸,以石墨为电极电解溶液获得Te。电解过程中阴极的电极反应式为_________________________________。
(5)25℃时,向1mol/L的Na2TeO3溶液中滴加盐酸,当溶液pH值约为6时,此时溶液中c(TeO32-):c(HTeO3-)=___________(已知:H2TeO3的Ka1=1.0×10-3,Ka2=2.0×10-8)
-
工业上常用铜阳极泥(主要成分是Cu2Te,含Ag、Au等杂质)为原料提取碲并回收金属,其工艺流程如下:
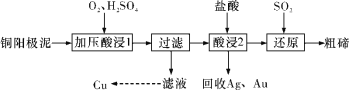
已知:TeO2是两性氧化物,微溶于水,易溶于较浓的强酸和强碱。下列说法错误的是
A.“加压酸浸1”过程中将碲元素转化成TeO2,应严格控制溶液的pH值
B.“酸浸2”过程中温度不能过高,否则会使碲的浸出率降低
C.从Ag和Au中分离出Au,应该向回收的Ag和Au中加入稀氨水
D.“还原”反应中发生的离子方程式为:TeO2+2SO2+2H2O=Te+2SO42-+4H+
-
硫是一种半导体材料,属于稀散金属,被誉为“现代工业、国防与尖端技术的维生素,创造人间奇迹的桥梁”,是当代高技术新材料的支撑材料。以碲化亚铜渣(主要物相为Cu2Te、Cu、CuSO4•5H2O、Au、Ag等)为原料提取与制备TeO2和单质Te的工艺流程如图所示:

已知:“水解”反应为H2TeO3(亚碲酸)=TeO2↓+H2O。
回答下列问题:
(1)Cu2Te中Te的化合价为___。
(2)“酸浸”时,要使6molCu溶解,与Cu反应的NaC1O3的物质的量为___。
(3)写出“酸浸”时Cu2Te发生转化的离子方程式:___。
(4)取碲化亚铜渣100g,氯酸钠添加质量和硫酸浓度对碲化亚铜渣浸出效果的影响如图所示:

选择最佳的氯酸钠添加质量为___g,选择硫酸的浓度约为___mol/L(保留小数点后一位)。
(5)“碱浸渣”中含有的金属单质主要有___(填化学式),具有很高的经济利用价值。
(6)“碱浸液”利用硫酸调节溶液pH至5.5,沉淀出TeO2,该过程的离子方程式为____。
(7)电沉积法是工业中制备纯Te的常用方法,以不锈钢板和普通铁板作阴、阳极,在一定的电流密度、温度下电解碱浸液,碲元素以金属Te形式在阴极析出,则阴极的电极反应式为___。
-
硫是一种半导体材料,属于稀散金属,被誉为“现代工业、国防与尖端技术的维生素,创造人间奇迹的桥梁”,是当代高技术新材料的支撑材料。以碲化亚铜渣(主要物相为Cu2Te、Cu、CuSO4•5H2O、Au、Ag等)为原料提取与制备TeO2和单质Te的工艺流程如图所示:
已知:“水解”反应为H2TeO3(亚碲酸)=TeO2↓+H2O。
回答下列问题:
(1)Cu2Te中Te的化合价为___。
(2)“酸浸”时,要使6molCu溶解,与Cu反应的NaC1O3的物质的量为___。
(3)写出“酸浸”时Cu2Te发生转化的离子方程式:___。
(4)取碲化亚铜渣100g,氯酸钠添加质量和硫酸浓度对碲化亚铜渣浸出效果的影响如图所示:
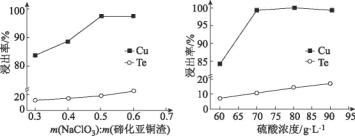
选择最佳的氯酸钠添加质量为___g,选择硫酸的浓度约为___mol/L(保留小数点后一位)。
(5)“碱浸渣”中含有的金属单质主要有___(填化学式),具有很高的经济利用价值。
(6)“碱浸液”利用硫酸调节溶液pH至5.5,沉淀出TeO2,该过程的离子方程式为____。
(7)电沉积法是工业中制备纯Te的常用方法,以不锈钢板和普通铁板作阴、阳极,在一定的电流密度、温度下电解碱浸液,碲元素以金属Te形式在阴极析出,则阴极的电极反应式为___。
-
氧族元素碲(Te)是当今高新技术新材料的主要成分之一。已知:TeO2是两性氧化物。工业上常用“铜阳极泥”(主要含Cu2Te,还含少量Ag、Au)为原料制备单质碲,其工艺流程如图所示。

回答下列问题:
(1)碲(Te)位于元素周期表第_________周期第ⅥA族;下列有关确的性质的叙述错误的是______。
A.碲的单质在常温下是固态 B.碲的常见化合价有-2、+4、+6
C.碲可能用作半导体材料 D.碲的氢化物H2Te很稳定
(2)实验室中“操作I”的名称是________,下列仪器与该实验操作无关的是________。
A.长颈漏斗 B.烧杯 C.锥形瓶 D.玻璃棒 E.容量瓶
(3)在“加压硫酸浸出”过程中,每消耗1mol Cu2Te反应生成TeOSO4,转移的电子数为________mol;“含硫浸出液”的溶质主要成分除TeOSO4外,还含有________(写化学式)。
(4)“电解沉积除铜”时,将“含酶浸出液”置于电解槽中,铜、确沉淀的关系如图所示。电解初始阶段阴极的电极反应式是__________。

(5)①向“含确硫酸铜溶液”中通入SO2还原TeOSO4生成磅的化学方程式为__________。
②上述反应在加入少量NaCl后,反应速率大幅度加快,则NaCl的主要作用为_____________。












