-
最近,美国普度大学的研究人员开发出一种利用铝镓合金加水制造氢气的新工艺。这项技术具有广泛的能源潜在用途,包括为汽车提供原料、为潜水艇提供燃料等。该技术通过向铝镓合金注水,铝生成氧化铝,同时生成氢气。合金中镓(Ga,ⅢA)是关键成分,可阻止铝形成致密的氧化膜。下列关于铝、镓的说法正确的是
A. 铝的金属性比镓强
B. 铝的熔点比镓低
C. Ga(OH)3与Al(OH)3性质相似,一定能与NaOH溶液反应
D. 铝、镓合金与水反应后的物质可以回收利用冶炼铝
难度: 简单查看答案及解析
-
已知分解1mol H2O2 放出热量98kJ,在含少量I-的溶液中,H2O2的分解机理为:H2O2+I-→H2O+IO- 慢,H2O2+IO-→H2O+O2+I- 快;下列有关反应的说法正确的是( )
A.反应的速率与I-的浓度有关 B.IO-也是该反应的催化剂
C.反应活化能等于98kJ·mol-1 D.v(H2O2)=v(H2O)=v(O2)
难度: 中等查看答案及解析
-
化学与生产、生活、环境等社会实际密切相关。下列叙述正确的是
A.“滴水石穿、绳锯木断”不涉及化学变化
B.明矾净水的原理和“84消毒液”消毒的原理不相同
C.加强化石燃料的开采利用,能从根本上解决能源危机
D.食品包装袋中常放入小袋的生石灰,目的是防止食品氧化变质
难度: 简单查看答案及解析
-
设NA表示阿伏加德罗常数值。下列说法正确的是
A.100g98%的浓硫酸中所含的氧原子数为4NA
B.常温下,Na2O2与N2和CO2组成的混合气体反应生成0.5mol O2时,转移电子数是2NA
C.1L 0.1mol/L HF溶液中含有共价键数目为0.1 NA
D.相同条件下,2NA氢原子所具有的能量大于NA氢分子所具有的能量
难度: 中等查看答案及解析
-
固体A的化学式NH5,它的所有原子的最外层都符合相应稀有气体原子的最外层电子结构,能与水反应,生成氢气和一种常见的弱电解质,则下列有关说法不正确的是
A.NH5 中既有离子键又有共价键 B.NH5属于离子化合物
C.1mol NH5中含有5mol N-H键 D.NH5溶于水形成的溶液呈碱性
难度: 中等查看答案及解析
-
A、B、C、D都是短周期元素,原子半径D>C>A>B ,已知A、B同周期相邻,A、C处于同一主族,C原子核内的质子数等于A、B原子核内的质子数之和,C原子最外层电子数是D原子最外层电子数的5倍,下列说法正确的是
A.A、C两元素可能处于第ⅢA族或第ⅥA族
B.D、B两元素组成的离子化合物阴阳离子之比为2:1或1:1
C.三种元素的简单离子的半径大小顺序为:C>D>B
D.D、C、B三种元素组成的化合物的化学式为D3CB4
难度: 中等查看答案及解析
-
向足量的硫酸溶液中加入200mL 0.4mol/L 的Ba(OH)2溶液,放出10.24kJ的热量。向足量的Ba(OH)2溶液中加入200mL 0.4mol/L 的HCl溶液,放出2.2kJ的热量。则硫酸钠溶液和氯化钡溶液反应的离子的热化学方程式为
A.Ba2+(aq)+SO42-(aq)=BaSO4(s) △H = -2.92 kJ/mol
B.Ba2+(aq)+SO42-(aq)=BaSO4(s) △H = -18 kJ/mol
C.Ba2+(aq)+SO42-(aq)=BaSO4(s) △H = -0.72 kJ/mol
D.Ba2+(aq)+SO42-(aq)=BaSO4(s) △H = -73 kJ/mol
难度: 中等查看答案及解析
-
下列热化学方程式中,正确的是
A.甲烷的燃烧热△H = -890.3kJ/mol,则甲烷燃烧的热化学方程式可表示为:CH4(g) + 2O2(g)═ CO2(g) + 2H2O(g) △H = -890.3kJ/mol
B.一定条件下,将0.5mol N2和1.5m01H2置于密闭容器中充分反应生成NH3放热19.3kJ其热化学方程式为:N2(g) + 3H2(g)
2NH3(g) △H =-38.6kJ/mol
C.在l01kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g) + O2(g)═2H2O(l) △H =-571.6kJ/mol
D.HCl和NaOH反应的中和热△H = -57.3kJ/mol,则H2SO4和Ca(OH)2反应的反应热△H = 2×(-57.3)kJ/mol
难度: 中等查看答案及解析
-
下列情况下,反应速率相同的是
A.等体积0.1 mol/L HCl和0.1 mol/L H2SO4分别与等质量的铁反应
B.等质量锌粒和锌粉分别与等量1 mol/L HCl反应
C.等体积等浓度HCl和HNO3分别与等质量的Na2CO3粉末反应
D.等体积0.2 mol/L HCl和0.1 mol/L H2SO4与等量等表面积等品质石灰石反应
难度: 中等查看答案及解析
-
一定量的盐酸跟过量的铁粉反应时,为了减缓反应速率,且不影响生成氢气的总量,可向盐酸中加入适量的
①NaOH固体 ②KNO3溶液 ③硫酸钾溶液 ④H2O
A.①③ B.③④ C.②③ D.②④
难度: 中等查看答案及解析
-
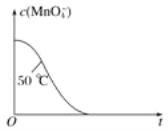
用纯净的CaCO3与100mL稀盐酸反应制取CO2,实验过程记录如图所示(CO2的体积已折算为标准状况下的体积).下列分析正确的是
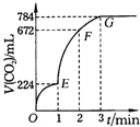
A.OE、EF、FG三段中,该反应用CO2表示的平均反应速率之比为2:6:7
B.EF段,用盐酸表示该反应的平均反应速率为2.4mol/(L•h)
C.G点表示收集的CO2的量最多
D.OE段表示的平均速率最大
难度: 中等查看答案及解析
-
20℃时,将5mL0.1mol/LNa2S2O3溶液和等体积、等浓度的稀H2SO4溶液混合,9min后溶液中明显出现浑浊现象;50℃时,同样的反应要看到同样的浑浊现象,仅需要20s的时间。则温度每升高10℃,反应速率增大到原来的
A.5倍 B.4倍 C.3倍 D.2倍
难度: 简单查看答案及解析
-
下列有关说法正确的是
A.铁片与稀盐酸制取氢气时,加入NaNO3固体或Na2SO4固体都不影响生成氢气的速率
B.加入反应物,单位体积内活化分子百分数增大,化学反应速率增大
C.汽车尾气中NO和CO可以缓慢反应生成N2和CO2,减小压强反应速率减慢
D.加入适宜的催化剂,非活化分子发生有效碰撞,化学反应速率增大
难度: 中等查看答案及解析
-
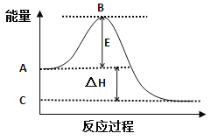
图是反应CO(g)+2H2(g)
CH3OH(g)进行过程中的能量变化曲线.下列相关说法正确的是
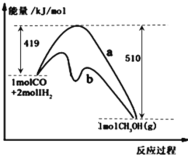
A.其它条件不变,按曲线b线进行的反应,CH3OH的产率更高
B.其它条件不变,分别按曲线a、b线进行的反应的热效应相同
C.(1molCO+2molH2)的键能之和比1molCH3OH的键能之和大
D.该反应的反应热△H= -91 kJ/mol,升高温度,正反应速率减小,逆反应速率增大
难度: 中等查看答案及解析
-
已知以下的热化学反应方程式:
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H=—24.8kJ·mol-1
②Fe2O3(s)+
CO(g)=
Fe3O4(s)+
CO2(g) △H=—15.73kJ·mol-1
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) △H=+640.4kJ·mol-1
则14gCO气体还原足量FeO固体得到Fe固体和CO2气体时对应的△H约为( )
A.-218kJ·mol-1 B.-109kJ·mol-1 C.+218kJ·mol-1 D.+109kJ·mol-1
难度: 简单查看答案及解析
-
符合如图所示的转化关系,且当X、Y、Z的物质的量相等时,存在焓变△H=△H1+△H2。满足上述条件的X、Y可能是
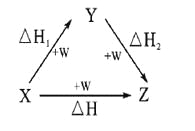
①C、CO ②S、SO2 ③Na、Na2O ④AlCl3、Al(OH)3⑤Fe、Fe(NO3)2 ⑥NaOH、Na2CO3
A.①④⑤ B.①②③ C.①③④ D.①③④⑤⑥
难度: 中等查看答案及解析
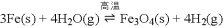 在一容积可变的密闭容器中进行,试回答:
在一容积可变的密闭容器中进行,试回答: