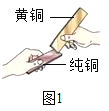
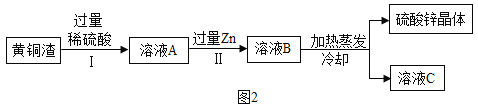
-
核电站中可用硼酸(H3BO3)吸收中子,阻断核辐射。硼酸中硼元素的化合价是
A. +1 B. +2 C. +3 D+4
难度: 简单查看答案及解析
-
煤炉越扇越旺,蜡烛一扇就灭,以下对该现象的分析正确的是( )
A.扇蜡烛会隔绝空气 B.扇蜡烛会降低石蜡着火点
C.扇煤炉会增大空气进入量 D.扇煤炉会增加新的易燃物
难度: 简单查看答案及解析
-
物质世界充满了变化。下列变化中,属于物理变化的是
A.光合作用
B.食物腐烂
C.冰山融化
D.纸张燃烧
难度: 简单查看答案及解析
-
下列物质的主要成分(括号内物质)属于氧化物的是
A.磷矿粉[Ca3(PO4)2] B.菱铁矿(FeCO3)
C.辉铜矿(Cu2S) D.铝土矿(Al2O3)
难度: 简单查看答案及解析
-
2015年4月10日,南京工业大学科研团队,在有机合成材料中成功观察到“长余辉”现象.并研制出纯有机的“夜明珠”.下列物品所用主要材料属于有机合成材料的是
A.不锈钢汤勺 B.塑料玩具 C.羊毛围巾 D.纯棉T桖
难度: 简单查看答案及解析
-
生活中某些物质的pH近似为:西瓜汁5.8、苹果汁3.1、泡菜3.4、鸡蛋清7.6,其中酸性最强的是
A.苹果汁 B.泡菜 C.西瓜汁 D.鸡蛋清
难度: 简单查看答案及解析
-
科学家发现月球土壤中含有较丰富的氦(He-3),其原子核内质子数为2,中子数为1,则氦原子的核外电子数为( )
A.1 B.2 C.3 D.4
难度: 简单查看答案及解析
-
下列实验操作叙述正确的是
A.倾倒液体时,试剂瓶口紧挨着试管口快速倒入
B.加热蒸发过程中,当溶液蒸干时再停止加热
C.过滤时,漏斗中液面应低于滤纸的边缘
D.测溶液pH时,将试纸直接浸入待测溶液中,再与标准比色卡比较
难度: 简单查看答案及解析
-
下列实验现象描述正确的是
A.红磷在空气中燃烧产生大量白雾
B.铁丝在空气中燃烧时,火星四射,生成黑色固体
C.木炭在氧气中燃烧发出白光,生成黑色固体
D.氢气在空气中燃烧,发出淡蓝色火焰
难度: 简单查看答案及解析
-
金属单质M与非金属单质硫发生如下反应:
,甲、乙两组学生在实验室分别进行该实验,加入的M和S的质量各不相同,充分反应后,实验数据记录见下表,则M的相对原子质量是 。
学生
M的质量/g
S的质量/g
M2S的质量/g
甲
6.0
2.5
7.5
乙
7.0
1.5
7.5
A.64
B.56
C.32
D.23
难度: 困难查看答案及解析
-
下列说法正确的是
A.大量使用化肥、农药能增加农作物产量
B.固体氢氧化钠可干燥氯化氢气体
C.洗涤剂除油污是其将油污溶解
D.浓硫酸和浓盐酸敞口放置一段时间后,溶质质量分数都变小
难度: 简单查看答案及解析
-
下列四个实验方案不合理的是
A.用过量CuSO4溶液除去铜粉中混有的少量铁粉
B.用点燃方法除去CO2中混有的少量CO
C.用加熟石灰研磨的方法鉴别硝酸铵和硝酸钾
D.用燃烧法鉴别羊毛线与棉线
难度: 中等查看答案及解析