-
化学与生产、生活密切相关,以下有关说法正确的是( )
A.用CO2合成聚碳酸酯不可降解塑料,实现“碳”的循环利用
B.绘制《山水画》所用的纸和墨的主要成分都是有机物
C.纯银器表面在空气中逐渐变暗,是发生了电化学腐蚀
D.海水是巨大的资源宝库,可以利用化学方法从海水中提取Br2、Mg等物质
难度: 中等查看答案及解析
-
设NA表示阿伏加德罗常数,下列说法正确的是( )
A.标况下,足量Zn与一定量的浓硫酸反应,产生22.4L氢气时,转移的电子数为2NA
B.6.4g S2和S8的混合物中,含硫原子总数为0.2NA
C.常温下,5.6g铁粉与足量的浓硝酸反应转移电子数为0.3NA
D.0.1mol/L的Na2CO3溶液中H2CO3、HCO3-、CO32-的粒子总数为0.1 NA
难度: 中等查看答案及解析
-
短周期主族元素W、X、Y、Z的原子序数依次增大,Wˉ与X+电子层结构相同,Y所在周期数与族序数相同,Z的最高价氧化物的水化物为强酸。下列说法正确的是( )
A.工业上用电解XZ的水溶液制备X单质
B.W、Z对应氢化物的沸点:W>Z
C.周期表中Z的氧化物对应水化物的酸性最强
D.Y是四种元素中简单离子半径最大的
难度: 中等查看答案及解析
-
下列叙述正确的是( )
A.利用石蜡油在碎瓷片上分解可得纯净的乙烯
B.甲烷和Cl2的反应与乙烯和Br2的反应属于同一类型的反应
C.苯可使溴水褪色,是发生了取代反应
D.C4H9Cl有4种同分异构体
难度: 中等查看答案及解析
-
下列根据实验操作和现象所得出的结论正确的是( )
选项
实验操作
实验现象
结论
A
将浓硫酸滴到纸上
纸张变黑
浓硫酸具有吸水性
B
测定等浓度的Na2CO3和Na2SO3的溶液的pH
前者pH比后者的大
非金属性:S>C
C
向2.0ml浓度均为0.1mol·L-1的KCl、KI混合溶液中滴加1~2滴0.01mol·L-1AgNO3溶液,振荡
沉淀呈黄色
Ksp(AgCl)>Ksp(AgI)
D
将镁条点然后迅速伸入集满CO2的集气瓶
集气瓶中有浓烟和黑色颗粒
CO2具有还原性
A.A B.B C.C D.D
难度: 困难查看答案及解析
-
氯气是一种重要的工业原料,液氯储存区贴有的说明卡如下:
包装
钢瓶
储运要求
远离金属粉末、氨、烃类、醇类物质;设置氯气检测仪
泄漏处理
NaOH、NaHSO3溶液吸收
下列解释事实的方程式不正确的是
A. 氯气用于自来水消毒:Cl2 + H2O
2H+ + Cl-+ ClO-
B. 电解饱和食盐水制取Cl2:2Cl- +2H2O
2OH-+ H2↑+Cl2↑
C. 浓氨水检验泄露的氯气,产生白烟:8NH3 + 3Cl2 === 6 NH4Cl + N2
D. 氯气“泄漏处理”中NaHSO3溶液的作用:HSO3-+ Cl2 + H2O === SO42-+ 3H+ + 2Cl-
难度: 中等查看答案及解析
-
纯的叠氮酸(HN3)是一种弱酸,常温下向25mL 0.1 mol/LNaOH溶液中加入0.2 mol/LHN3溶液,滴加过程中的pH值的变化曲线(溶液混合时的体积变化忽略不计)如下图。下列说法不正确的是( )
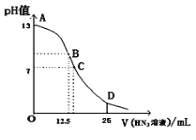
A.该滴定过程中应用酚酞作指示剂
B.若B点pH=8,则c(HN3)=(10-6-10-8 )mol/L
C.点D对应溶液中存在关系:c(N3-)>c(Na+)>c(HN3)
D.沿曲线A→B→C的过程中,由水电离产生的c(OH-)逐渐减少
难度: 困难查看答案及解析
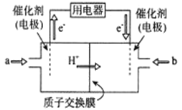
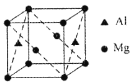
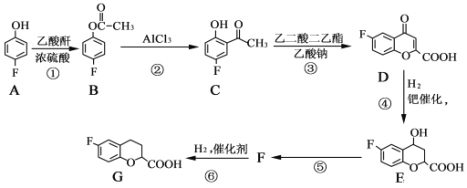
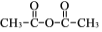 。
。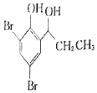 的合成路线流程图(无机试剂任选)_____________。(合成路线流程图示例如下:CH3CH2Br
的合成路线流程图(无机试剂任选)_____________。(合成路线流程图示例如下:CH3CH2Br