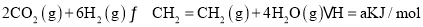-
科学家积极探索新技术对CO2进行综合利用, CO2可用来合成低碳烃。
CO2(g) +4H2(g)  CH4(g) + 2H2O(g) ΔH= a kJ/mol
CH4(g) + 2H2O(g) ΔH= a kJ/mol
(1)已知:①4H2(g)+ 2O2(g)=4H2O(g) △H=-967.2kJ/mol.
②CH4(g) + 2O2(g) =CO2(g) + 2H2O(g) ΔH=-802.0 kJ/mol.
请回答:①②这两个反应在热力学上趋势均很大,其原因是__________________; a=____________kJ/mol。
(2)在体积为1L的密闭刚性容器中,充入4mol H2和1mol CO2,测得温度对CO2的平衡转化率和催化剂催化效率的影响如图1所示。
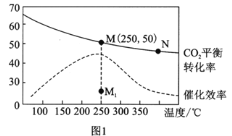
①已知M点总压为1MPa,该反应在此温度下的平衡常数Kp=______MPa-2。(Kp是用平衡分压代替平衡浓度表示的化学平衡常数,气体分压=气体总压×体积分数。)
②欲增加二氧化碳的平衡转化率,可采取的措施有__________。
A.通入惰性气体 B.提高温度
C.增加二氧化碳浓度 D.增加氢气浓度
③下列说法正确的是_________。
A.平衡常数大小:KN>KM
B.其他条件不变,若不使用催化剂,则250℃ 时CO2的平衡转化率可能位于点M1
C.图1中M点时,甲烷的体积分数为12.5%
D.当压强或n( H2)/n(CO2)不变时均可证明化学反应已达到平衡状态
(3)新型高效的甲烷燃料电池工作时总反应式:CH4+2O2=CO2+2H2O。
①该电池的负极是___________(填a或b),②负极电极反应式为___________;
-
科学家积极探索新技术对CO2进行综合利用。
Ⅰ.CO2可用来合成低碳烯烃:2CO2(g)+6H2(g) CH2=CH2(g)+4H2O(g) △H=akJ/mol
CH2=CH2(g)+4H2O(g) △H=akJ/mol
请回答:
(1)已知:H2和CH2=CH的燃烧热分别是285.8kJ/mol和1411.0kJ/mol,且H2O(g) H2O((1)△H=-44.0kJ/mol,则a=________kJ/mol。
H2O((1)△H=-44.0kJ/mol,则a=________kJ/mol。
(2)上述由CO2合成CH2=CH2的反应在________下自发进行(填“高温”或“低温”)。
(3)在体积为1L的恒容密闭容器中,充入3molH2和1molCO2,测得温度对CO2的平衡转化率和催化剂催化效率的影响如图1所示。下列说法正确的是________。
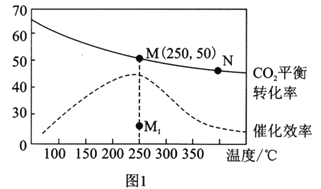
A.平衡常数大小:KMN
B.其他条件不变,若不使用催化剂,则250℃时CO2的平衡转化率可能位于点M1
C.图1中M点时,乙烯的体积分数为7.7%
D.当压强或n(H2)/n(CO2)不变时均可证明化学反应已达到平衡状态
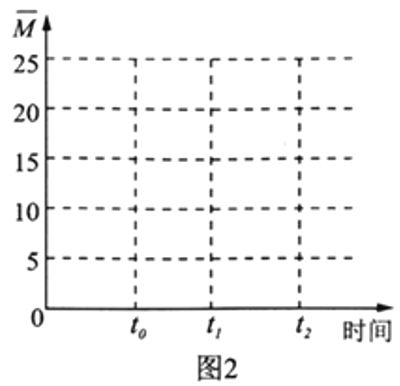
(4)保持温度不变,在体积为V L的恒容容器中以n(H2)∶n(CO2)=3∶1的投料比加入反应物,t0时达到化学平衡。请在图2中作出容器内混合气体的平均相对分子质量 随时间变化的图象。___________
随时间变化的图象。___________
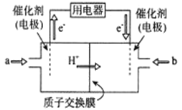
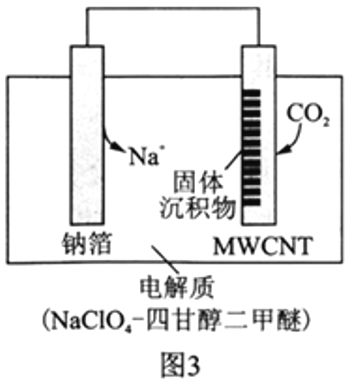
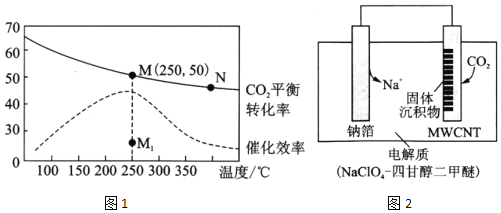
Ⅱ.利用“Na-CO2”电池将CO2变废为宝。我国科研人员研制出的可充电“Na-CO2”电池,以钠箔和多壁碳纳米管(MWCNT)为电极材料,总反应为4Na+3CO2 2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图3所示:
2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图3所示:
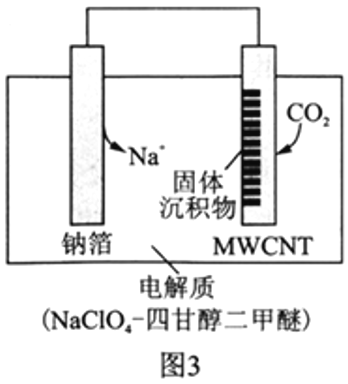
(5)放电时,正极的电极反应式为__________________。
(6)若生成的Na2CO3和C全部沉积在正极表面,当转移0.2mole-时,正极增加的质量为_______g。
(7)选用高氯酸钠四甘醇二甲醚做电解液的优点是_____________________。
-
科学家积极探索新技术对CO2进行综合利用。
Ⅰ.CO2可用来合成低碳烯烃:2CO2(g)+6H2(g) CH2=CH2(g)+4H2O(g) △H=akJ/mol
CH2=CH2(g)+4H2O(g) △H=akJ/mol
请回答:
(1)已知:H2和CH2=CH的燃烧热分别是285.8kJ/mol和1411.0kJ/mol,且H2O(g) H2O((1)△H=-44.0kJ/mol,则a=________kJ/mol。
H2O((1)△H=-44.0kJ/mol,则a=________kJ/mol。
(2)上述由CO2合成CH2=CH2的反应在________下自发进行(填“高温”或“低温”)。
(3)在体积为1L的恒容密闭容器中,充入3molH2和1molCO2,测得温度对CO2的平衡转化率和催化剂催化效率的影响如图1所示。下列说法正确的是________。
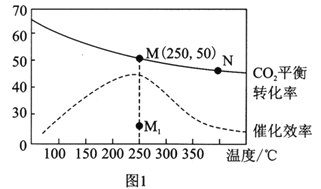
A.平衡常数大小:KMN
B.其他条件不变,若不使用催化剂,则250℃时CO2的平衡转化率可能位于点M1
C.图1中M点时,乙烯的体积分数为7.7%
D.当压强或n(H2)/n(CO2)不变时均可证明化学反应已达到平衡状态
(4)保持温度不变,在体积为V L的恒容容器中以n(H2)∶n(CO2)=3∶1的投料比加入反应物,t0时达到化学平衡。请在图2中作出容器内混合气体的平均相对分子质量 随时间变化的图象。___________
随时间变化的图象。___________
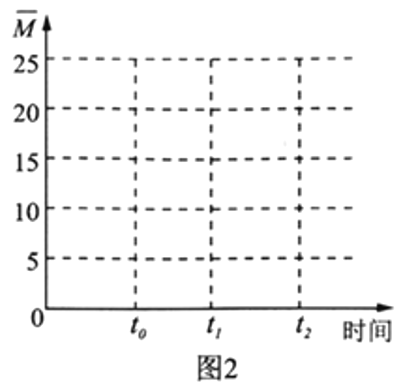
Ⅱ.利用“Na-CO2”电池将CO2变废为宝。我国科研人员研制出的可充电“Na-CO2”电池,以钠箔和多壁碳纳米管(MWCNT)为电极材料,总反应为4Na+3CO2 2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图3所示:
2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图3所示:
(5)放电时,正极的电极反应式为__________________。
(6)若生成的Na2CO3和C全部沉积在正极表面,当转移0.2mole-时,正极增加的质量为_______g。
(7)选用高氯酸钠四甘醇二甲醚做电解液的优点是_____________________。
-
科学家积极探索新技术对CO2进行综合利用。
I. CO2可用来合成低碳烯烃。
2CO2(g) +6H2(g) CH2 =CH2(g) +4H2O(g) ΔH= akJ/mol
CH2 =CH2(g) +4H2O(g) ΔH= akJ/mol
请回答:
(1)已知:H2和CH2 =CH2的燃烧热分别是285.8kJ/mol和1411.0kJ/mol,且H2O(g) H2O(1) ΔH = -44.0 kJ/mol,则 a=____________kJ/mol。
H2O(1) ΔH = -44.0 kJ/mol,则 a=____________kJ/mol。
(2)上述由CO2合成CH2 =CH2的反应在__________下自发进行(填“高温”或“低温”),理由是___________________。
(3)在体积为1 L的密闭容器中,充入3 mol H2和1 mol CO2,测得温度对CO2的平衡转化率和催化剂催化效率的影响如图1所示。下列说法正确的是_________。

A.平衡常数大小:KM>KN
B.其他条件不变,若不使用催化剂,则250℃时CO2的平衡转化率可能位于点M1
C.图1中M点时,乙烯的体积分数为7.7%
D.当压强或n( H2)/n(CO2)不变时均可证明化学反应已达到平衡状态
(4)保持温度不变,在体积为VL的恒容容器中以n(H2)∶n(CO2) = 3∶1的投料比加入反应物,t0时达到化学平衡。t1时将容器体积瞬间扩大至2V L并保持不变,t2时重新达平衡。请在图2中作出容器内混合气体的平均相对分子质量 随时间变化的图象_________。
随时间变化的图象_________。
II .利用“ Na—CO2”电池将CO2变废为宝。
我国科研人员研制出的可充电“ Na—CO2”电池,以钠箔和多壁碳纳米管(MWCNT)为电极材料,总反应为4Na+3CO2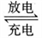 2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图3所示:
2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图3所示:
(5)放电时,正极的电极反应式为______________________。
(6)若生成的Na2CO3和C全部沉积在电极表面,当转移0.2 mol e-时,两极的质量差为_________g。
(7)选用髙氯酸钠—四甘醇二甲醚做电解液的优点是___________________________(至少写两点)。
-
科学家积极探索新技术对CO2进行综合利用。
I. CO2可用来合成低碳烯烃。
2CO2(g) +6H2(g) CH2 =CH2(g) +4H2O(g) ΔH= akJ/mol
CH2 =CH2(g) +4H2O(g) ΔH= akJ/mol
请回答:
(1)已知:H2和CH2 =CH2的燃烧热分别是285.8kJ/mol和1411.0kJ/mol,且H2O(g) H2O(1) ΔH = -44.0 kJ/mol,则 a=____________kJ/mol。
H2O(1) ΔH = -44.0 kJ/mol,则 a=____________kJ/mol。
(2)上述由CO2合成CH2 =CH2的反应在__________下自发进行(填“高温”或“低温”),理由是___________________。
(3)在体积为1 L的密闭容器中,充入3 mol H2和1 mol CO2,测得温度对CO2的平衡转化率和催化剂催化效率的影响如图1所示。下列说法正确的是_________。

A.平衡常数大小:KM>KN
B.其他条件不变,若不使用催化剂,则250℃时CO2的平衡转化率可能位于点M1
C.图1中M点时,乙烯的体积分数为7.7%
D.当压强或n( H2)/n(CO2)不变时均可证明化学反应已达到平衡状态
(4)保持温度不变,在体积为VL的恒容容器中以n(H2)∶n(CO2) = 3∶1的投料比加入反应物,t0时达到化学平衡。t1时将容器体积瞬间扩大至2V L并保持不变,t2时重新达平衡。请在图2中作出容器内混合气体的平均相对分子质量 随时间变化的图象_________。
随时间变化的图象_________。
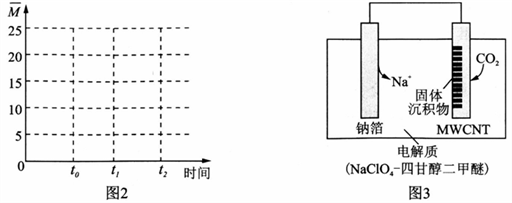
II .利用“ Na—CO2”电池将CO2变废为宝。
我国科研人员研制出的可充电“ Na—CO2”电池,以钠箔和多壁碳纳米管(MWCNT)为电极材料,总反应为4Na+3CO2 2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图3所示:
2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图3所示:
(5)放电时,正极的电极反应式为______________________。
(6)若生成的Na2CO3和C全部沉积在电极表面,当转移0.2 mol e-时,两极的质量差为_________g。
(7)选用髙氯酸钠—四甘醇二甲醚做电解液的优点是___________________________(至少写两点)。
-
科学家积极探索新技术对 进行综合利用.
进行综合利用.
I. 可用来合成低碳烯烃.
可用来合成低碳烯烃.
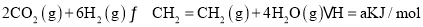
请回答:
 已知:
已知: 和
和 的燃烧热分别是
的燃烧热分别是 和
和 ,且
,且 ,则
,则  ______
______ .
.
 上述由
上述由 合成
合成 的反应在______下自发进行
的反应在______下自发进行 填“高温”或“低温”
填“高温”或“低温” ,理由是______.
,理由是______.
 在体积为1L的密闭容器中,充入3mol
在体积为1L的密闭容器中,充入3mol  和1mol
和1mol  ,测得温度对
,测得温度对 的平衡转化率和催化剂催化效率的影响如图1所示.下列说法正确的是______.
的平衡转化率和催化剂催化效率的影响如图1所示.下列说法正确的是______.
A 平衡常数大小:
B 其他条件不变,若不使用催化剂,则 时
时 的平衡转化率可能位于点
的平衡转化率可能位于点
C 图1中M点时,乙烯的体积分数为
D 当压强或
 不变时均可证明化学反应已达到平衡状态
不变时均可证明化学反应已达到平衡状态
 利用“
利用“ ”电池将
”电池将 变废为宝.
变废为宝.
我国科研人员研制出的可充电“ ”电池,以钠箔和多壁碳纳米管
”电池,以钠箔和多壁碳纳米管 为电极材料,总反应为
为电极材料,总反应为 放电时该电池“吸入”
放电时该电池“吸入” ,其工作原理如图2所示:
,其工作原理如图2所示:
 放电时,正极的电极反应式为______.
放电时,正极的电极反应式为______.
 若生成的
若生成的 和C全部沉积在电极表面,当转移
和C全部沉积在电极表面,当转移
 时,两极的质量差为______
时,两极的质量差为______
 选用髙氯酸钠
选用髙氯酸钠 四甘醇二甲醚做电解液的优点是______
四甘醇二甲醚做电解液的优点是______ 至少写两点
至少写两点 .
.
-
科学家积极探索新技术对CO2进行综合利用。
Ⅰ.CO2可用FeO 吸收获得H2。
i. 6FeO(s) +CO2(g)=2Fe3O4(s) +C(s) △Hl =-76.0 kJ·mol-1
ⅱ. C(s) +2H2O(g)=CO2(g) +2H2(g) △H2 = +113.4 kJ·mol-1
(1)3FeO(s) +H2O(g)= Fe3O4(s) +H2(g) △H3 =_________。
(2)在反应i中,每放出38.0 kJ热量,有______g FeO被氧化。
Ⅱ.CO2可用来生产燃料甲醇。
CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。在体积为1L的恒容密闭容器中,充入1 mol CO2和3 mol H2,一定条件下发生反应:测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。在体积为1L的恒容密闭容器中,充入1 mol CO2和3 mol H2,一定条件下发生反应:测得CO2和CH3OH(g)的浓度随时间变化如图所示。
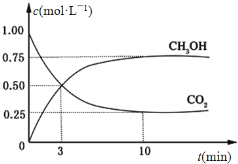
(3)从反应开始到平衡,氢气的平均反应速率v(H2)=___________________ mol·(L·min) -1。
(4)氢气的转化率=________________________。
(5)该反应的平衡常数为__________________________ (保留小数点后2位)。
(6)下列措施中能使平衡体系中n(CH3OH)/n(CO2)增大的是_____________________。
A.升高温度 B.充入He(g),使体系压强增大
C.再充入1 mol H2 D.将H2O(g)从体系中分离出去
(7)当反应达到平衡时,H2的物质的量浓度为c1,然后向容器中再加入一定量H2,待反应再一次达到平衡后,H2的物质的量浓度为c2,则c1________c2的关系(填“>”、“<”或“=”)。
III.CO2可用碱溶液吸收获得相应的原料。
利用100 mL 3 mol·L—1NaOH溶液吸收4.48 LCO2(标准状况),得到吸收液。
(8)该吸收液中离子浓度的大小排序为___________________。将该吸收液蒸干,灼烧至恒重,所得固体的成分是_________(填化学式)。
-
科学家积极探索新技术对CO2进行综合利用。请回答下列问题:
(1)已知: H2的燃烧热为285.8kJ/mol,C2H4的燃烧热为1411.0kJ/mol,且H2O(g)=H2O(l)ΔH=-44.0kJ/mol,则CO2 和H2反应生成乙烯和水蒸气的热化学方程式为____________,上述反应在__________下自发进行(填“高温”或“低温”)。
(2)乙烯是一种重要的气体燃料,可与氧气、熔融碳酸钠组成燃料电池。写出该燃料电池负极的电极反应式:_______________________.
(3)在体积为1L的密闭容器中,充入3mol H2和1mol CO2,测得温度对CO2的平衡转化率和催化剂催化效率的影响如图所示。
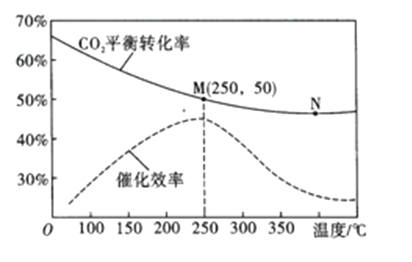
①平衡常数: KM__________KN (填“>”“<”或“=”)。
②下列说法正确的是_________(填序号)。
A.当混合气体密度不变时,说明反应达到平衡状态
B.当压强或n(H2)/n(CO2)不变时,均可证明反应已达平衡状态
C.当温度高于250℃时,因为催化剂的催化效率降低,所以平衡向逆反应方向移动
D.若将容器由“恒容”换为“恒压”,其他条件不变,则CO2的平衡转化率增大
③250℃时,将平衡后的混合气体(不考虑平衡移动) 通入300mL 3mol/L的NaOH溶液中充分反应,则所得溶液中所有离子的浓度大小关系为__________
④图中M点对应乙烯的质量分数为_____________。
(5)达平衡后,将容器体积瞬间扩大至2L并保持不变,平衡向_____移动(填“正向”“逆向”或“不”),容器内混合气体的平均相对分子质量______(填“增大”“减小”或“不变”)。
-
科学家积极探索新技术对CO2进行综合利用。请回答下列问题:
(1)已知: H2的燃烧热为285.8kJ/mol,C2H4的燃烧热为1411.0kJ/mol,且H2O(g)=H2O(l)ΔH=-44.0kJ/mol,则CO2 和H2反应生成乙烯和水蒸气的热化学方程式为____________,上述反应在__________下自发进行(填“高温”或“低温”)。
(2)乙烯是一种重要的气体燃料,可与氧气、熔融碳酸钠组成燃料电池。写出该燃料电池负极的电极反应式:_______________________.
(3)在体积为1L的密闭容器中,充入3mol H2和1mol CO2,测得温度对CO2的平衡转化率和催化剂催化效率的影响如图所示。
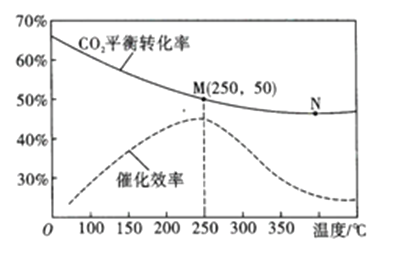
①平衡常数: KM__________KN (填“>”“<”或“=”)。
②下列说法正确的是_________(填序号)。
A.当混合气体密度不变时,说明反应达到平衡状态
B.当压强或n(H2)/n(CO2)不变时,均可证明反应已达平衡状态
C.当温度高于250℃时,因为催化剂的催化效率降低,所以平衡向逆反应方向移动
D.若将容器由“恒容”换为“恒压”,其他条件不变,则CO2的平衡转化率增大
③250℃时,将平衡后的混合气体(不考虑平衡移动) 通入300mL 3mol/L的NaOH溶液中充分反应,则所得溶液中所有离子的浓度大小关系为__________
④图中M点对应乙烯的质量分数为_____________。
(5)达平衡后,将容器体积瞬间扩大至2L并保持不变,平衡向_____移动(填“正向”“逆向”或“不”),容器内混合气体的平均相对分子质量______(填“增大”“减小”或“不变”)。
-
科学家利用“组合转化”等技术对CO2进行综合利用。如用H2 和CO2在一定条件下可以合成乙烯:6H2(g)+2CO2(g) CH2=CH2(g)+4H2O(g) △H=a kJ/mol
CH2=CH2(g)+4H2O(g) △H=a kJ/mol
(1)已知:①H2和CH2=CH2的燃烧热(△H)分别为-285.8kJ/mol和-1411kJ/mol
②H2O(g)= H2O(l) △H=-44 kJ/mol 则a= kJ/mol。
(2)不同温度对CO2的转化率及催化剂的效率影响如图所示,下列有关说法不正确的是 (填序号)。
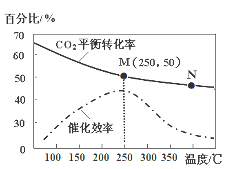
①不同条件下反应,N点的速率最大
②温度低于250℃时,随温度升高乙烯的产率增大
③M点时平衡常数比N点时平衡常数大
④实际反应应尽可能在较低的温度下进行,以提高 CO2的转化率
(3)若在密闭容器中充入体积比为 3∶1的 H2 和CO2,则图中M点时,产物CH2=CH2的体积分数为 ;若要进一步提高乙烯的体积分数,可采取的措施有 。
(4)科学家开发了一种新型陶瓷(主要成分为Li4SiO4),在500℃时可高效吸收CO2,同时生成 Li2CO3;该材料在700℃时可再生循环。请写出表示该过程的化学方程式________。
(5)利用高温电解技术可将CO2转化为高热值的燃料CO:
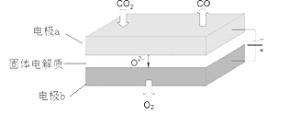
电极a发生 (填“氧化”或“还原”)反应;电极反应式为 。
CH4(g) + 2H2O(g) ΔH= a kJ/mol










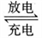 2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图3所示:
2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图3所示:

 2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图3所示:
2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图3所示: