-
三氯氢硅(SiHCl3)是制备硅烷、多晶硅的重要原料。回答下列问题:
对于反应2SiHCl3(g)=SiH2Cl2(g)+SiCl4(g),采用大孔弱碱性阴离子交换树脂催化剂,在323K和343K时SiHCl3的转化率随时间变化的结果如图所示。
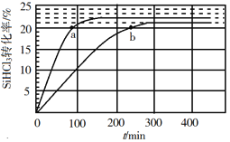
在343K下:要提高SiHCl3转化率,可采取的措施是___;要缩短反应达到平衡的时间,可采取的措施有___、___。
-
煤燃烧排放的烟气含有SO2和NOx,形成酸雨、污染大气,采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝。回答下列问题:
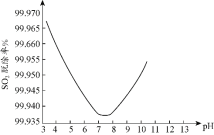
在鼓泡反应器中通入含有SO2和NO的烟气,反应温度为323K,NaClO2溶液浓度为5×10−3mol·L−1。反应一段时间后溶液中离子浓度的分析结果如表。
| 离子 | SO42− | SO32− | NO3− | NO2− | Cl− |
| c/(mol·L−1) | 8.35×10−4 | 6.87×10−6 | 1.5×10−4 | 1.2×10−5 | 3.4×10−3 |
由实验结果可知,脱硫反应速率___脱硝反应速率(填“大于”或“小于”)。原因是除了SO2和NO在烟气中的初始浓度不同,还可能是___。
-
催化还原CO2是解决温室效应及能源问题的重要手段之一,研究表明,在Cu/ZnO催化剂存在下,CO2和H2可发生两个平行反应,分别生成CH3OH和CO,反应的热化学方程式如下:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H1=-53.7kJ•mol-1 I
CH3OH(g)+H2O(g) △H1=-53.7kJ•mol-1 I
CO2(g)+H2(g) CO(g)+H2O(g) △H2 II
CO(g)+H2O(g) △H2 II
某实验室控制CO2和H2初始投料比为1︰2.2,在相同压强下,经过相同反应时间测得如下实验数据:
| T(K) | 催化剂 | CO2转化率(%) | 甲醇选择性(%) |
| 543 | Cat.1 | 12.3 | 42.3 |
| 543 | Cat.2 | 10.9 | 72.7 |
| 553 | Cat.1 | 15.3 | 39.1 |
| 553 | Cat.2 | 12.0 | 71.6 |
[备注]Cat.1:Cu/ZnO纳米棒;Cat.2:Cu/ZnO纳米片;甲醇选择性:转化的CO2中生成甲醇的百分比
(1)表中实验数据表明,在相同温度下不同的催化剂对CO2转化成CH3OH的选择性有显著的影响,其原因是___。
(2)在如图中分别画出反应I在无催化剂、有Cat.1和有Cat.2三种情况下“反应过程-能量”示意图___。

-
甲醇是重要的化工原料,又可称为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g) CH3OH(g) △H1
CH3OH(g) △H1
②CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H2
CH3OH(g)+H2O(g) △H2
③CO2(g)+H2(g) CO(g)+H2O(g) △H3
CO(g)+H2O(g) △H3
回答下列问题:
(1)反应①的化学平衡常数K的表达式为___;图1中能正确反映平衡常数K随温度变化关系的曲线为___(填曲线标记字母),其判断理由是___。
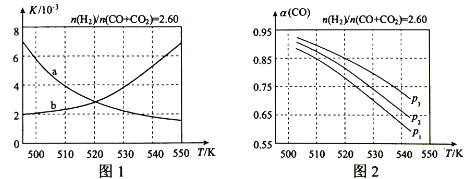
(2)合成气的组成 =2.60时,体系中的CO平衡转化率(α)与温度和压强的关系如图2所示。α(CO)值随温度升高而___(填“增大”或“减小”),其原因是___。图2中的压强由大到小为___,其判断理由是___。
=2.60时,体系中的CO平衡转化率(α)与温度和压强的关系如图2所示。α(CO)值随温度升高而___(填“增大”或“减小”),其原因是___。图2中的压强由大到小为___,其判断理由是___。
-
乙苯催化脱氢制苯乙烯反应: +H2(g)。
+H2(g)。
工业上,通常在乙苯蒸气中掺混水蒸气(原料气中乙苯和水蒸气的物质的量之比为1︰9),控制反应温度600℃,并保持体系总压为常压的条件下进行反应。在不同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的选择性(指除了H2以外的产物中苯乙烯的物质的量分数)示意图如图:
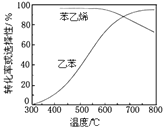
①掺入水蒸气能提高乙苯的平衡转化率,解释说明该事实___。
②控制反应温度为600℃的理由是___。
-
在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g) 2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
(1)100℃时达到平衡后,改变反应温度为T,c(N2O4)以0.0020mol·L-1·s-1的平均速率降低,经10s又达到平衡。T___100℃(填“大于”“小于”),判断理由是___。
(2)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向___(填“正反应”或“逆反应”)方向移动,判断理由是___。
-
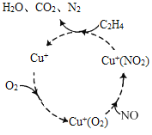
NH3经一系列反应可以得到HNO3,如图所示。
II中,2NO(g)+O2 2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率在不同压强(P1、P2)下温度变化的曲线(如图)。
2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率在不同压强(P1、P2)下温度变化的曲线(如图)。
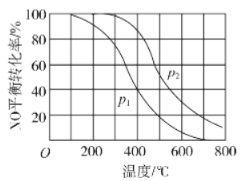
①比较P1、P2的大小关系:___。
②随温度升高,该反应平衡常数变化的趋势是___。
-
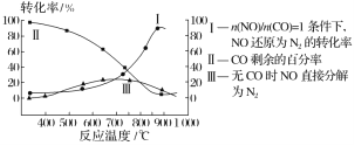
NOx(主要指NO和NO2)是大气主要污染物之一。有效去除大气中的NOx是环境保护的重要课题。
在有氧条件下,新型催化剂M能催化NH3与NOx反应生成N2。
①NH3与NO2生成N2的反应中,当生成1molN2时,转移的电子数为___mol。
②将一定比例的O2、NH3和NOx的混合气体,匀速通入装有催化剂M的反应器中反应(装置见图)。
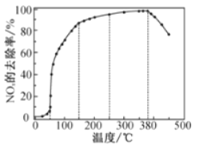
反应相同时间NOx的去除率随反应温度的变化曲线如图所示,在50~250 ℃范围内随着温度的升高,NOx的去除率先迅速上升后上升缓慢的主要原因是___;当反应温度高于380℃时,NOx的去除率迅速下降的原因可能是___。
-
CH4-CO2催化重整不仅可以得到合成气(CO和H2),还对温室气体的减排具有重要意义。回答下列问题:
反应中催化剂活性会因积碳反应而降低,同时存在的消碳反应则使积碳量减少。
相关数据如下表:
| 积碳反应 CH4(g)=C(s)+2H2(g) | 消碳反应 CO2(g)+C(s)=2CO(g) |
| ΔH/(kJ·mol−1) | 75 | 172 |
| 活化能/ (kJ·mol−1) | 催化剂X | 33 | 91 |
| 催化剂Y | 43 | 72 |
①由上表判断,催化剂X___Y(填“优于”或“劣于”),理由是___。
-
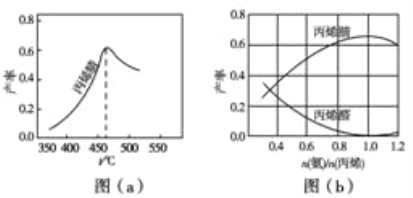
丁烯是一种重要的化工原料,可由丁烷催化脱氢制备。回答下列问题:
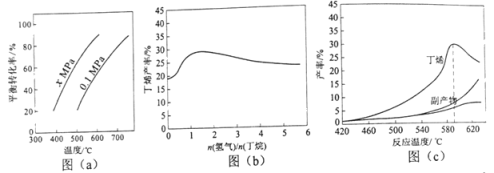
(1)丁烷和氢气的混合气体以一定流速通过填充有催化剂的反应器(氢气的作用是活化催化剂),出口气中含有丁烯、丁烷、氢气等。图(b)为丁烯产率与进料气中 的关系。图中曲线呈现先升高后降低的变化趋势,其降低的原因是___。
的关系。图中曲线呈现先升高后降低的变化趋势,其降低的原因是___。
(2)图(c)为反应产率和反应温度的关系曲线,副产物主要是高温裂解生成的短碳链烃类化合物。丁烯产率在590℃之前随温度升高而增大的原因可能是___、___;590℃之后,丁烯产率快速降低的主要原因可能是__。
-
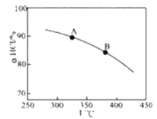
用O2将HCl转化为Cl2,可提高效益,减少污染,
新型RuO2催化剂对上述HCl转化为Cl2的总反应具有更好的催化活性,
在上述实验中若压缩体积使压强增大,画出相应aHCl—T曲线的示意图,并简要说明理由___。
-
煤炭燃烧过程中会释放出大量的SO2,严重破坏生态环境。采用一定的脱硫技术可以把硫元素以CaSO4的形式固定,从而降低SO2的排放。但是煤炭燃烧过程中产生的CO又会与CaSO4发生化学反应,降低脱硫效率。相关反应的热化学方程式如下:
CaSO4(s)+CO(g) CaO(s)+SO2(g)+CO2(g) ΔH1=218.4kJ·mol-1(反应Ⅰ)
CaO(s)+SO2(g)+CO2(g) ΔH1=218.4kJ·mol-1(反应Ⅰ)
CaSO4(s)+4CO(g) CaS(s)+4CO2(g) ΔH2=-175.6kJ·mol-1(反应Ⅱ)
CaS(s)+4CO2(g) ΔH2=-175.6kJ·mol-1(反应Ⅱ)
请回答下列问题:
通过监测反应体系中气体浓度的变化判断反应Ⅰ和Ⅱ是否同时发生,理由是___。
-
用CaSO4代替O2与燃料CO反应,既可以提高燃烧效率,又能得到高纯CO2,是一种高效、清洁、经济的新型燃烧技术,反应①为主反应,反应②和③为副反应。
①1/4CaSO4(s)+CO(g) 1/4CaS(s)+CO2(g) △H1=-47.3kJ/mol
1/4CaS(s)+CO2(g) △H1=-47.3kJ/mol
②CaSO4(s)+CO(g) CaO(s)+ CO2(g)+ SO2(g) △H2=+210.5kJ/mol
CaO(s)+ CO2(g)+ SO2(g) △H2=+210.5kJ/mol
③CO(g) 1/2C(s)+1/2CO2(g) △H3=-86.2kJ/mol
1/2C(s)+1/2CO2(g) △H3=-86.2kJ/mol
反应①~③的平衡常数的对数lgK随反应温度T的变化曲线见图,结合各反应的△H,归纳lgK~T曲线变化规律:

a)___;b)___。
-
二甲醚(CH3OCH3)是一种应用前景广阔的清洁燃科,以CO和氢气为原料生产二甲醚主要发生以下三个反应:
| 编号 | 热化学方程式 | 化学平衡常数 |
| ① | CO(g)+2H2(g) CH3OH(g) ΔH1 CH3OH(g) ΔH1 | K1 |
| ② | 2CH3OH(g) CH3OCH3(g)+H2O(g) ΔH2=-24kJ/mol CH3OCH3(g)+H2O(g) ΔH2=-24kJ/mol | K2 |
| ③ | CO(g)+H2O(g) CO2(g)+H2(g) ΔH3=-41kJ/mol CO2(g)+H2(g) ΔH3=-41kJ/mol | K3 |
回答下列问题:
工艺中反应①和反应②分别在不同的反应器中进行,无反应③发生。该工艺中反应③的发生提高了CH3OCH3的产率,原因是___。
-
氮的氧化物(NOx)是大气主要污染物,有效去除大气中的NOx是环境保护的重要课题。
在有氧条件下,新型催化剂M能催化NH3与NOx反应生成N2,将一定比例的O2、NH3和NOx的混合气体匀速通入装有催化剂M的反应器中反应,反应相同时间,NOx的去除率随反应温度的变化曲线如图所示。
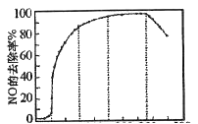
①在50℃~150℃范围内随温度升高,NOx的去除率迅速上升的原因是___。
②当反应温度高于380℃时,NOx的去除率迅速下降的原因可能是___。
-
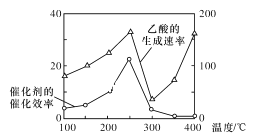
大气中CO2含量的增加会加剧温室效应,为减少其排放,需将工业生产中产生的CO2分离出来进行储存和利用。
以TiO2/Cu2Al2O4为催化剂,可以将CO2和CH4直接转化为乙酸,请写出该反应的化学方程式:____。在不同温度下催化剂的催化效率与乙酸的生成速率的关系如图所示。在温度为____时,催化剂的活性最好,效率最高。请解释图中250~400℃时乙酸生成速率变化的原因:250~300℃时___;300~400℃时___。
-
汽车发动机工作时会产生包括CO、NOx等多种污染气体,涉及到如下反应:
①N2(g)+O2(g) 2NO(g)
2NO(g)
②2NO(g)+O2(g) 2NO2(g)
2NO2(g)
③NO2(g)+CO(g) CO2(g)+NO(g)
CO2(g)+NO(g)
弄清上述反应的相关机理,对保护大气环境意义重大,回答下列问题:
科学家研究出了一种高效催化剂,可以将CO和NO2两者转化为无污染气体,反应方程式为:2NO2(g)+4CO(g)=4CO2(g)+N2(g) △H<0
某温度下,向10L密闭容器中分别充入0.1molNO2和0.2molCO,发生上述反应,随着反应的进行,容器内的压强变化如表所示:
| 时间/min | 0 | 2 | 4 | 6 | 8 | 10 | 12 |
| 压强/kPa | 75 | 73.4 | 71.95 | 70.7 | 69.7 | 68.75 | 68.75 |
回答下列问题:
若将温度降低,再次平衡后,与原平衡相比体系压强(p总)如何变化?___(填“增大”、“减小”或“不变”),原因是____。
-
二氧化碳的有效回收利用,既能缓解能源危机,又可减少温室效应的影响,具有解决能源问题及环保问题的双重意义。Zn/ZnO热化学循环还原CO2制CO的原理如图所示,回答下列问题:
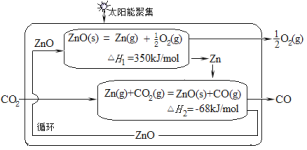
(1)①Zn/ZnO在反应中循环使用,其作用是___。
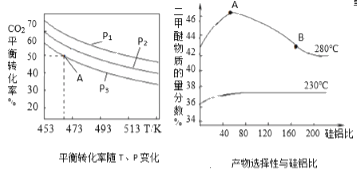
(2)二甲醚是主要的有机物中间体,在一定条件下利用CO2与H2可直接合成二甲醚:2CO2(g) +6H2(g) CH3OCH3(g)+3H2O(g),
CH3OCH3(g)+3H2O(g), =3时,实验测得CO2的平衡转化率随温度及压强变化如图所示。
=3时,实验测得CO2的平衡转化率随温度及压强变化如图所示。
合成二甲醚过程中往往会生成一氧化碳,合成时选用硅铝化合物做催化剂,硅铝比不同时,生成二甲醚或一氧化碳的物质的量分数不同。硅铝比与产物选择性如图所示。图中A点和B点的化学平衡常数比较:KA___KB(填“>、<、=”)。根据以上两条曲线,写出其中一条变化规律:___。
-
硒(Se)是第四周期ⅥA族元素,是人体内不可或缺的微量元素,其氢化物H2Se是制备新型光伏太阳能电池、半导体材料和金属硒化物的基础原料。
T℃时,向一恒容密闭容器中加入3molH2和lmolSe,发生反应H2(g)+Se(s) H2Se(g)。
H2Se(g)。
①当反应达到平衡后,将平衡混合气体通入气体液化分离器使H2Se气体转化为液体H2Se,并将分离出的H2再次通入发生反应的密闭容器中继续与Se反应时,Se的转化率会提高。请用化学平衡理论解释___。
-
工业废气、汽车尾气中含有的NOx、SO2等,是形成雾霾的主要物质,其综合治理是当前重要的研究课题。
某研究小组探究催化剂对CO、NO转化的影响。将NO和CO以一定的流速通过两种不同的催化剂进行反应,相同时间内测量逸出气体中的NO含量,从而确定尾气脱氮率(脱氮率即NO的转化率),结果如图所示。
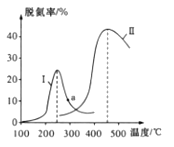
若温度低于200℃,图中曲线脱氯率随温度升高而变化不大的主要原因是___;判断a点对应的脱氮率是否为对应温度下的平衡脱氮率,并说明其理由:____。
-
氮氧化物是评价空气质量的控制标准之一,作为空气污染物的氮氧化物(NOx)常指NO和NO2。
T1℃时,在刚性反应器中以投料比为1:3的NO(g)与O2(g)反应,其中NO2二聚为N2O4的反应可以迅速达到平衡。体系的总压强p随时间t的变化如下表所示[t=∞时,NO(g)完全反应]。
| t/min | 0 | 40 | 80 | 160 | 260 | 700 | ∞ |
| p/kPa | 32.8 | 30.7 | 29.9 | 29.4 | 29.2 | 28.8 | 26.9 |
若降低反应温度至T2℃,则NO(g)与O2(g)完全反应后体系压强p∞(T2℃)____(填“大于”“等于”或“小于”)26.9kPa,原因是___。

O2(g)=C3H3N(g)+3H2O(g) ΔH =−515 kJ/mol
4N2(g)+6H2O(g);ΔH=-1627kJ•mol-1
会直接影响该方法的脱硝率。如图为350℃时,只改变氨气的投放量,NO的百分含量与氨氮比的关系图。当
>1.0时,烟气中NO含量反而增大,主要原因是___。




 +H2(g)。
+H2(g)。












