-
化学与生活、生产、环境、能源关系密切。下列说法错误的是 ( )
A.将草木灰与NH4H2PO4混合使用,可更好为植物提供N、P、K三种营养元素
B.开发高效氢能、太阳能等新型电动汽车,以解决城市机动车尾气排放问题
C.《本草纲目》中记载:“此即地霜也。所在山泽,冬月地上有霜,扫取以水淋汁,后乃煎炼而成。”文中对硝酸钾的提取涉及溶解、蒸发、结晶操作
D.重金属盐中毒者可以用鸡蛋清进行急救,K2FeO4可作饮用水的消毒剂和净水剂
难度: 中等查看答案及解析
-
NA为阿伏加德罗常数的值。下列说法正确的是( )
A.标准状况下,2.24LHF和2.24LNH3中均含有电子数为NA
B.40g KH(氢化钾:M=40 g·mol-1)与足量水反应转移电子数为2NA
C.1.0L 1.0mo1·L-1的NaAlO2水溶液中含有的氧原子数为2NA
D.标准状况下,4.48L甲烷和乙烯的混合气体中所含C-H键数目为0.8NA
难度: 中等查看答案及解析
-
人们将连有四个不同基团的碳原子形象地称为手性碳原子。曙红可用作指示剂及染料,其结构简式如图所示。下列有关曙红的说法正确的是 ( )
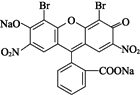
A.曙红不能与盐酸发生反应
B.1个曙红分子中含1个手性碳原子
C.1 mol曙红最多能与3 mol NaOH反应
D.曙红能发生取代、加成、消去反应
难度: 中等查看答案及解析
-
锂碘电池的正极材料是聚2-乙烯吡啶(简写为P2VP)和I2的复合物,电解质是熔融薄膜状的碘化锂,该电池发生的总反应为2Li+P2VP·nI2
P2VP·(n-1)I2+2LiI。下列说法正确的是 ( )
A.该电池放电时,锂电极发生还原反应
B.该电池放电时,碘离子移向正极
C.P2VP和I2的复合物是绝缘体,不能导电,充电时与外电源的负极相连
D.放电时正极的电极反应式为P2VP·nI2+2e-+2Li+=P2VP·(n-1)I2+2LiI
难度: 中等查看答案及解析
-
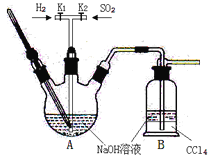
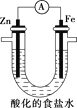
某学习小组拟探究CO2和锌粒反应是否生成CO,已知CO能与银氨溶液反应产生黑色固体。实验装置如图所示,下列说法正确的是 ( )
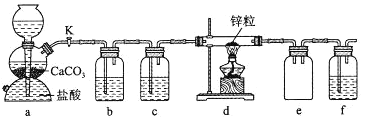
A.实验开始时,先点燃酒精灯,后打开活塞K
B.b、c、f中试剂依次为氢氧化钠溶液、浓硫酸、银氨溶液
C.a中所发生反应的离子方程式是CaCO3+2H+=CO2↑+Ca2++H2O
D.装置e的作用是收集一氧化碳气体
难度: 中等查看答案及解析
-
W、X、Y、Z为短周期元素且原子序数依次增大,Y在短周期中原子半径最大。W、X、Z可组成化合物甲,X、Y、Z可组成化合物乙;将甲、乙两溶液混合,有淡黄色沉淀生成,并产生能使品红溶液褪色的无色气体。下列说法错误的是 ( )
A.Y分别与X、Z组成的化合物中所含化学键类型一定完全相同
B.室温下,W、X、Y组成的化合物的水溶液pH一定大于7
C.原子半径:Y>Z>X>W
D.简单氢化物的沸点:X>Z
难度: 中等查看答案及解析
-
已知常温下,0.1 mol/L的NH4HCO3溶液pH=7.8。往碳酸的饱和水溶液中通入NH3,测得含氮(或含碳)各微粒的分布分数(平衡时某种微粒的浓度占各种微粒浓度之和的分数)与pH的关系如图所示。下列说法错误的是 ( )
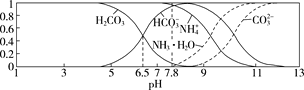
A.常温下,Kb(NH3·H2O)>Ka1(H2CO3)
B.向pH=6.5的上述溶液中通入NH3时,NH4+和HCO3-浓度都逐渐减小
C.NH4HCO3溶液中存在关系:c(NH4+)+c(NH3·H2O)=c(HCO3-)+c(CO32-)+c(H2CO3)
D.当溶液的pH=9时,溶液中存在下列关系:c(HCO3-)>c(NH4+)>c(NH3·H2O)>c(CO32-)
难度: 中等查看答案及解析
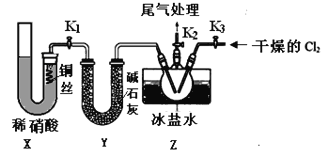
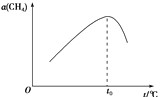
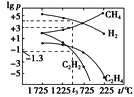
 分别表示CH4、C2H2、H2和固体催化剂,在固体催化剂表面CH4的裂解过程如图所示。从吸附到解吸的过程中,能量状态最低的是________(填字母)。
分别表示CH4、C2H2、H2和固体催化剂,在固体催化剂表面CH4的裂解过程如图所示。从吸附到解吸的过程中,能量状态最低的是________(填字母)。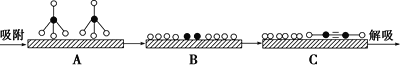

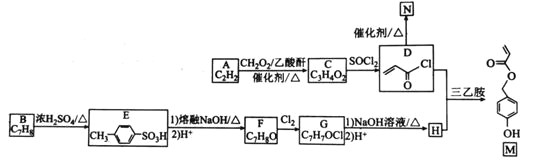
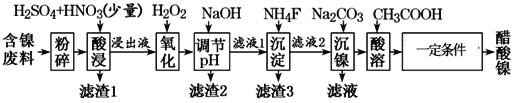
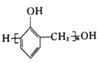 的合成路线
的合成路线