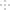-
焦亚硫酸钠(Na2S2O5:M=190 g·mol-1)在食品加工中常用作防腐剂、漂白剂和疏松剂。焦亚硫酸钠为黄色结晶粉末,150℃时开始分解,在水溶液或含有结晶水时更易被空气氧化。焦亚硫酸钠(Na2S2O5)在实验室可用如图装置制备。
已知:2NaHSO3 Na2S2O5 + H2O S2O52-+2H+=2SO2↑+H2O
Na2S2O5 + H2O S2O52-+2H+=2SO2↑+H2O
(1)实验中如果SO2通入过多,会降低Na2S2O5的产率,试解释其原因__________。
(2)测定产品中焦亚硫酸钠的质量分数常用剩余碘量法(杂质不与碘反应)。
已知:S2O52-+2I2+3H2O=2SO42-+4I-+6H+; 2S2O32-+I2 =S4O62-+2I-
称取0.2000 g产品放入碘量瓶中,加入40.00 mL 0.1000 mol·L-1的标准碘溶液,在暗处放置5 min,再加入适量冰醋酸及蒸馏水。用0.2000 mol·L-1的标准Na2S2O3溶液滴定剩余的碘至终点,重复操作3次,测得平均消耗标准Na2S2O3溶液20.00 mL。则产品中焦亚硫酸钠的质量分数为__________________。
(3)关于本实验的说法错误的是_________。
A.B装置中CCl4的作用是防止倒吸
B.滴定时,Na2S2O3溶液应该用碱式滴定管盛放
C.滴定终点的现象是刚好变蓝色
D.滴定时间过长会导致测得产品中焦亚硫酸钠的质量分数偏高
-
焦亚硫酸钠(Na2S2O5)在食品加工中常用作防腐剂、漂白剂和疏松剂。焦亚硫酸钠为黄色结晶粉末,150℃时开始分解,在水溶液或含有结晶水时更易被空气氧化。实验室制备焦亚硫酸钠过程中依次包含以下几步反应:
2NaOH + SO2 = Na2SO3 + H2O ……(a);
Na2SO3+ H2O + SO2 = 2NaHSO3 ……(b);
2NaHSO3 Na2S2O5 + H2O ……(c);
Na2S2O5 + H2O ……(c);
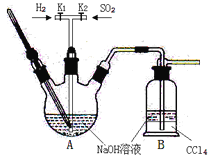
实验装置如下:
(1)实验室可用废铝丝与NaOH溶液反应制取H2,制取H2的离子方程式为 。
(2)图-1装置中,导管X的作用是 。
(3)通氢气一段时间后,以恒定速率通入SO2,开始的一段时间溶液温度迅速升高,随后温度缓慢变化,溶液开始逐渐变黄。“温度迅速升高”的原因为 ;实验后期须保持温度在约80℃,可采用的加热方式为 。
(4)反应后的体系中有少量白色亚硫酸钠析出,参照图-2溶解度曲线,除去其中亚硫酸钠固体的方法是 ;然后获得较纯的无水Na2S2O5应将溶液冷却到30℃左右抽滤,控制“30℃左右”的理由是 。
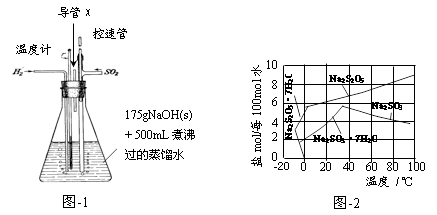
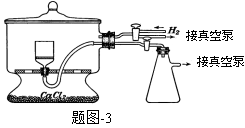
(5)用图-3装置干燥Na2S2O5晶体时,通入H2的目的是 ;真空干燥的优点是 。
(6)测定产品中焦亚硫酸钠的质量分数常用剩余碘量法。已知:S2O52-+2I2+3H2O=2SO42-+4I-+6H+;2S2O32-+I2 = S4O62-+2I-
请补充实验步骤(可提供的试剂有:焦亚硫酸钠样品、标准碘溶液、淀粉溶液、酚酞溶液、标准Na2S2O3溶液及蒸馏水)。
①精确称取产品0.2000g放入碘量瓶(带磨口塞的锥形瓶)中。
②准确移取一定体积和已知浓度的标准碘溶液(过量)并记录数据,在暗处放置5min,然后加入5mL冰醋酸及适量的蒸馏水。
③用标准Na2S2O3溶液滴定至接近终点。
④ 。
⑤ 。
⑥重复步骤①~⑤;根据相关记录数据计算出平均值。
-
焦亚硫酸钠(Na2S2O5)在食品加工中常用作防腐剂、漂白剂和疏松剂。焦亚硫酸钠为黄色结晶粉末,150℃时开始分解,在水溶液或含有结晶水时更易被空气氧化。实验室制备焦亚硫酸钠过程中依次包含以下几步反应:
2NaOH + SO2 = Na2SO3 + H2O……(a)
Na2SO3+ H2O + SO2 = 2NaHSO3 ……(b)
2NaHSO3  Na2S2O5 + H2O……(c)
Na2S2O5 + H2O……(c)
实验装置如下:

(1)实验室可用废铝丝与NaOH溶液反应制取H2,制取H2的离子方程式为 。
(2)题图-1装置中,导管X的作用是 。
(3)通氢气一段时间后,以恒定速率通入SO2,开始的一段时间溶液温度迅速升高,随后温度缓 慢变化,溶液开始逐渐变黄。“温度迅速升高”的原因为 ;
慢变化,溶液开始逐渐变黄。“温度迅速升高”的原因为 ;
实验后期须保持温度在约80℃,可采用的加热方式为 。
(4)反应后的体系中有少量白色亚硫酸钠析出,参照题图-2溶解度曲线,除去其中亚硫酸钠固体的方法是 ;然后获得较纯的无水Na2S2O5应将溶液冷却到30℃左右抽滤,控制“30℃左右”的理由是 。
(5)用题图-3装置干燥Na2S2O5晶体时,通入H2的目的是 ;真空干燥的优点是 。
(6)测定产品中焦亚硫酸钠的质量分数常用剩余碘量法。已知:S2O52-+2I2+3H2O=2SO42-+4I-+6H+;2S2O32-+I2 = S4O62-+2I-
请补充实验步骤(可提供的试剂有:焦亚硫酸钠样品、标准碘溶液、淀粉溶液、酚酞溶液、标准Na2S2O3溶液及蒸馏水)。
①精确称取产品0.2000g放入碘量瓶(带磨口塞的锥形瓶)中。
②准确移取一定体积和已知浓度的标准碘溶液(过量)并记录数据,在暗处放置5min,然后加入5mL冰醋酸及适量的蒸馏水。
③用标准Na2S2O3溶液滴定至接近终点。④ 。 ⑤ 。
⑥重复步骤①~⑤;根据相关记录数据计算出平均值。
-
焦亚硫酸钠(Na2S2O5)在食品加工中常作防腐剂、漂白剂、疏松剂,焦亚硫酸钠具有还原性,受潮和温度高于150℃易分解。焦亚硫酸钠与亚硫酸氢钠的转化关系是:Na2S2O5 NaHSO3。工业上制取原理是用纯碱与亚硫酸氢钠溶液混合而成的悬浮液吸收二氧化硫至过饱和,再从亚硫酸氢钠过饱和溶液中结晶析出焦亚硫酸钠产品。实验室模拟制取焦亚硫酸钠流程如图。
NaHSO3。工业上制取原理是用纯碱与亚硫酸氢钠溶液混合而成的悬浮液吸收二氧化硫至过饱和,再从亚硫酸氢钠过饱和溶液中结晶析出焦亚硫酸钠产品。实验室模拟制取焦亚硫酸钠流程如图。
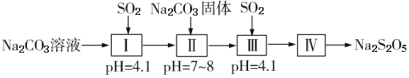
(1)Ⅰ中用Na2CO3溶液吸收SO2,随着SO2的持续通入,溶液中各组分的质量分数变化如图1所示。图中线2表示的组分是___(填化学式,下同)。Ⅰ中产物是___。
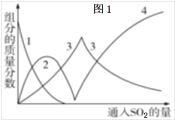
(2)实验时采用80℃的水浴加热,反应后的体系中有少量亚硫酸钠析出,根据图2溶解度曲线,获得较纯的无水Na2S2O5的方法是___。
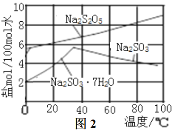
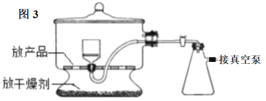
(3)图3为真空干燥Na2S2O5晶体的装置,真空干燥的目的是___。
(4)测定产品中焦亚硫酸钠的质量分数常用剩余碘量法(杂质不与碘反应)。
已知:S2O +2I2+3H2O=2SO
+2I2+3H2O=2SO +4I-+6H+;2S2O
+4I-+6H+;2S2O +I2=S4O
+I2=S4O +2I-。
+2I-。
实验步骤如下:
①称取0.2000g产品放入碘量瓶中。
②加入40.00mL0.1000mol·L-1的标准碘溶液,在暗处放置5min,再加入适量冰醋酸及蒸馏水。
③用0.2000mol·L-1的标准Na2S2O3溶液滴定剩余的碘至接近终点。
④加入1~2mL淀粉溶液。
⑤继续用标准Na2S2O3溶液滴定至___,记录滴定所消耗的体积。
⑥重复步骤①~⑤;平均消耗标准Na2S2O3溶液20.00mL。则产品中焦亚硫酸钠的质量分数为___。
-
焦亚硫酸钠(Na2S2O5)在食品加工中常作防腐剂、漂白剂、疏松剂,焦亚硫酸钠具有还原性,受潮和温度高于150℃易分解,在空气中易被氧化为Na2SO4。
(一)实验室可采用下图1装置制取Na2S2O5。装置Ⅱ中有Na2S2O5晶体析出,发生的反应为:Na2SO3+SO2=Na2S2O5。
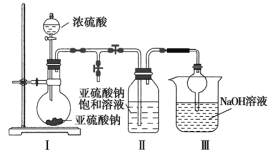
(1)Ⅲ装置中球形干燥管的作用是______________________,要从装置Ⅱ中获得已析出的晶体可采取的分离方法是____________________。
(2)焦亚硫酸钠在空气中久置会被氧化生成连二硫酸钠(Na2S2O6),写出该反应的化学方程式__________________________________________。已知Na2S2O5溶于水即生成NaHSO3。检测Na2S2O5晶体在空气中是否被氧化的实验方案为________________________________。
(二)工业上制取原理是用纯碱与亚硫酸氢钠溶液混合而成的悬浮液吸收二氧化硫至过饱和,再从亚硫酸氢钠过饱和溶液中结晶析出焦亚硫酸钠产品。实验室模拟工业制取焦亚硫酸钠流程如下:
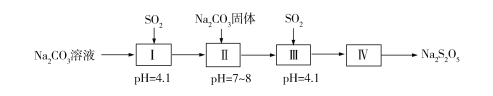
(3)Ⅱ中添加Na2CO3固体目的是________________,Ⅲ中为了减少对环境的污染,需要及时停止通入SO2,此时测量的数据是___________。
(三)测定产品中焦亚硫酸钠的质量分数常用剩余碘量法。
已知:S2O52-+2I2+3H2O=2SO42-+4I-+6H+;2S2O32-+I2 = S4O62-+2I-
①精确称取产品0.20 g放入碘量瓶(带磨口塞的锥形瓶)中。
②准确移取10.00 mL,1.00 mol/L的标准碘溶液(过量),在暗处放置5min,然后加入5mL冰醋酸及适量的蒸馏水。
③用标准1.00 mol/L Na2S2O3溶液滴定至接近终点,重复操作3次,平均消耗标准液17.60 mL。
(4)根据上述实验,计算产品纯度为______%(保留一位小数)。若实验过程中滴定终点俯视读数,则测定的结果______(填“偏高”、“偏低”、“无影响”)。
-
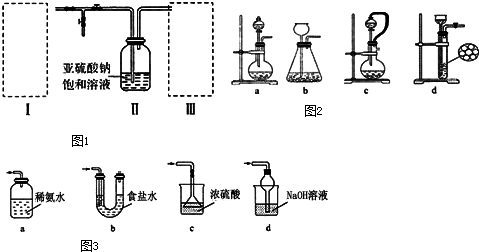
(10分)焦亚硫酸钠(Na2S2O5)为白色或黄色结晶粉末或小结晶。其性质活泼,具有强还原性,在食品加工中作防腐剂、漂白剂、疏松剂。某实验小组拟采用如图1装置(实验前已除尽装置内的空气)来制取焦亚硫酸钠(Na2S2O5).
(1)装置I是用亚硫酸钠固体和浓硫酸制备二氧化硫气体,该装置中反应的化学方程式为 .如果想控制反应速度,如图2中可选用的发生装置是 (填写字母).
(2)装置Ⅱ中发生反应的化学方程式为:2 NaHSO3=Na2S2O5 + H2O,当有Na2S2O5晶体析出,要获得已析出的晶体可采取的分离方法是 ;某同学需要420mL0.1mol/L焦亚硫酸钠溶液来研究其性质,配制时需称量焦亚硫酸钠的质量为 ;配制时除用到托盘天平、药匙、烧杯、玻璃棒等仪器外,还必须用到的玻璃仪器是 .
(3)装置Ⅲ用于处理尾气,可选用如图3的最合理装置(夹持仪器已略去)为 (填序号).
-
焦亚硫酸钠(Na2S2O5)为白色或黄色结晶粉末或小结晶。其性质活泼,具有强还原性,在食品加工中作防腐剂、漂白剂、疏松剂。某实验小组拟采用如图1装置(实验前已除尽装置内的空气)来制取焦亚硫酸钠(Na2S2O5).
(1)装置I是用亚硫酸钠固体和浓硫酸制备二氧化硫气体,该装置中反应的化学方程式 为 .如果想控制反应速度,如图2中可选用的发生装置是 (填写字母).
(2)工业上为减少SO2的排放,常采取的措施有:将煤转化为清洁气体燃料。已知:
H2(g)+1/2O2(g)=H2O(g)  H= -241.8KJ/mol C(s)+1/2O2(g)=CO(g)
H= -241.8KJ/mol C(s)+1/2O2(g)=CO(g)  H= -110.5KJ/mol
H= -110.5KJ/mol
写出焦炭与水蒸气反应的热化学方程式
(3)洗涤含SO2的烟气,以下物质可作洗涤剂的是 (填编号)
a.Ca(OH)2 b.Na2CO3 c.CaCl2 d.NaHSO3
(4)装置Ⅱ中发生反应的化学方程式为:2 NaHSO3=Na2S2O5 + H2O当有Na2S2O5晶体析出,要获得已析出的晶体可采取的分离方法是 ;某同学需要420mL0.1mol/L焦亚硫酸钠溶液来研究其性质,配制时需称量焦亚硫酸钠的质量为 ;配制时除用到托盘天平、药匙、烧杯、玻璃棒等仪器外,还必须用到的玻璃仪器是 .
(5)装置Ⅲ用于处理尾气,可选用如图3的最合理装置(夹持仪器已略去)为 (填序号).
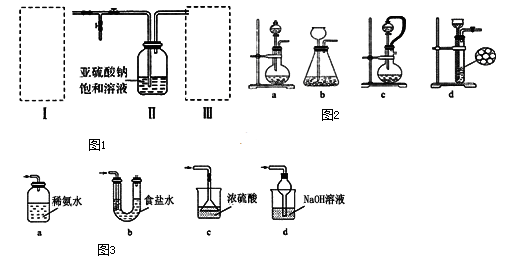
(6)工业制备焦亚硫酸钠(Na2S2O5)的过程如图:
已知:反应Ⅱ包含2NaHSO3 Na2S2O5+H2O等多步反应。
Na2S2O5+H2O等多步反应。
①实验室制取氨气的化学方程式: 。
②“灼烧”时发生反应的化学方程式: 。
③已知Na2S2O5与稀硫酸反应放出SO2,其离子方程式为: 。
④副产品X的化学式是: ;可循环利用的物质是:__________________。
⑤为了减少产品Na2S2O5中杂质含量,需控制反应Ⅱ中气体与固体的物质的量之比约为 。
-
食品加工中常用焦亚硫酸钠(Na2S2O5)作漂白剂、防腐剂和疏松剂。现实验室欲制备焦亚硫酸钠,其反应依次为:(ⅰ)2NaOH+SO2=Na2SO3+H2O;
(ⅱ)Na2SO3+H2O+SO2=2NaHSO3;
(ⅲ)2NaHSO3 Na2S2O5+H2O。
Na2S2O5+H2O。
查阅资料:焦亚硫酸钠为黄色结晶粉末,150℃时开始分解,在水溶液或含有结晶水时更易被空气氧化。
实验装置如下:
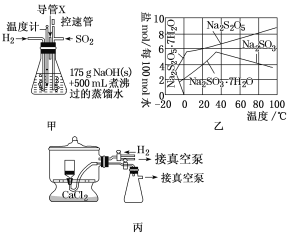
(1)实验室可用废铝丝与NaOH溶液制取H2,其离子方程式为___。
(2)通氢气一段时间后,以恒定速率通入SO2,开始的一段时间溶液温度迅速升高,随后温度缓慢变化,溶液开始逐渐变黄。“温度迅速升高”的原因为__。实验后期须利用水浴使温度保持在约80℃。
(3)反应后的体系中有少量白色亚硫酸钠析出,除去其中亚硫酸钠固体的方法是___;然后获得较纯的无水Na2S2O5,应将溶液冷却到30℃左右过滤,控制“30℃左右”的理由是___。
(4)丙为真空干燥Na2S2O5晶体的装置,通入H2的目的是___。
(5)常用剩余碘量法测定产品中焦亚硫酸钠的质量分数。已知:S2O52-+2I2+3H2O=2SO42-+4I-+6H+;2S2O32-+I2=S4O62-+2I-。请补充实验步骤(可提供的试剂有:焦亚硫酸钠样品、标准碘溶液、淀粉溶液、酚酞溶液、标准Na2S2O3溶液及蒸馏水)。
①精确称取产品0.2000g放入碘量瓶(带磨口塞的锥形瓶)中。
②准确移取一定体积的已知浓度的标准碘溶液(过量)并记录数据,在暗处放置5min,然后加入5mL冰醋酸及适量的蒸馏水。
③用标准Na2S2O3溶液滴定至接近终点。
④___。
⑤重复步骤①~③;根据相关记录数据计算出平均值。
-
焦亚硫酸钠(Na2S2O5)可用作还原剂,印染媒染剂、食品防腐剂等。一种湿法制备焦亚酸钠的工艺流程如图。
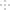
已知:过饱和NaHSO3溶液经结晶、离心分离、干燥制得Na2S2O5。
(1)硫磺先加热成液态后喷人燃硫炉中,作用是__。
(2)“净化”需要除去的杂质气体是__。
(3)溶碱槽Ⅰ中需要通入足量SO2,若SO2不足,则生成__。
(4)溶碱槽Ⅲ中反应的化学方程式为__。
(5)离心机分离后的母液需要返回到溶碱槽__循环使用(填“Ⅰ”、“Ⅱ”或“Ⅲ”)。
(6)气流干燥器中发生的化学方程式为__。
(7)为了测定所得产品中Na2S2O5的百分含量,取m克样品加水溶解,用cmol·L-1的碘标准液滴定到终点消耗碘标准液VmL.该产品中Na2S2O5的百分含量为__(用字母表示)。
-
焦亚硫酸钠(Na2S2O5)常用作食品漂白剂。其制备工艺流程如下:
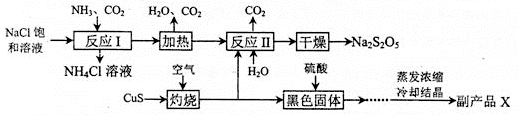
已知:反应II包含2NaHSO3=Na2S2O5+ H2O等多步反应。
(1)反应I的总化学方程式为 ,反应I进行时应先通入的气体是 ,反应I产生的NH4Cl可用作_______________。
(2)灼烧时发生反应的化学方程式为 ,若灼烧时生成SO2 1.12×l06 L(标准状况下),则转移电子 mol。
(3)己知Na2S2O5与稀硫酸反应放出SO2,其离子方程式为 。
(4)副产品X的化学式是 ,在上述流程中可循环使用的物质是 。
(5)为了减少产品Na2S2O5中杂质含量,需控制反应II中气体与固体的物质的量之比约为 ,检验产品中含有碳酸钠杂质所需试剂 。(填编号)。
①澄清石灰水 ②饱和碳酸氢钠溶液 ③氢氧化钠 ④酸性高锰酸钾 ⑤稀硫酸

Na2S2O5 + H2O S2O52-+2H+=2SO2↑+H2O