-
短周期主族元素X、Y、Z、W原子序数依次增大,X原子最外层有6个电子,Y是至今发现的非金属性最强的元素且无正价,Z在周期表中处于周期序数等于族序数的位置,W的单质广泛用作半导体材料.下列叙述正确的是( )
A.原子半径由大到小的顺序:W、Z、Y、X
B.原子最外层电子数由多到少的顺序:Y、X、W、Z
C.元素非金属性由强到弱的顺序:Z、W、X
D.简单气态氢化物的稳定性由强到弱的顺序:X、Y、W
难度: 中等查看答案及解析
-
“PM2.5”是指大气中直径小于或等于2.5微米的颗粒物.它与空气中的SO2接触时,SO2会部分转化为SO3.则“PM2.5”的颗粒物在酸雨形成过程中主要的作用是下列的( )
A. 还原作用 B. 氧化作用 C. 催化作用 D. 抑制作用
难度: 简单查看答案及解析
-
下列各组中互为同位素的一组是
A.O2、O3 B.Na2O、Na2O2 C.40K、40Ca D.H、D、T
难度: 简单查看答案及解析
-
有以下六种原子:6Li、7Li、23Na、24Mg、14C、14N,下列相关说法不正确的是
A.6Li 和7Li在元素周期表中所处的位置相同
B.14C 和14N质量数相等,二者互为同位素
C.23Na和24Mg的中子数相同但不属于同种元素
D.7Li的质量数和14N的中子数相等
难度: 简单查看答案及解析
-
下列化学实验事实及其解释都正确的是
A.过量的铜屑与稀硝酸作用,反应停止后,再加入1 mol/L稀硫酸,铜屑又逐渐溶解是因为铜可直接与1 mol/L稀硫酸反应
B.工业上用电解熔融氯化铝的方法制备金属铝是因为氯化铝的熔点低
C.铁钉放在浓硝酸中浸泡后,再用蒸馏水冲洗,然后放入CuSO4溶液中不反应,说明铁钉表面形成了一层致密稳定的氧化膜
D.工业制玻璃的主要反应之一:Na2CO3+SiO2
Na2SiO3+CO2↑,该反应原理可用“强酸H2CO3制弱酸H2SiO3”来解释
难度: 中等查看答案及解析
-
下列反应结束后,固体质量减少的是( )
A.二氧化碳通过灼热的镁粉 B.铝粉与Fe3O4发生铝热反应
C.含有铜屑的NaNO3溶液加入少量盐酸 D.铜丝插入AgNO3溶液中
难度: 中等查看答案及解析
-
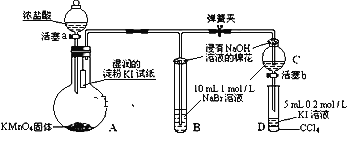
下列图示箭头方向表示与某种常见试剂在通常条件下(不含电解)发生转化,其中6步转化均能一步实现的一组物质是
选项
W
X
Y
Z
A
N2
NH3
NO
NO2
B
Na
Na2O2
NaOH
Na2CO3
C
Cu
CuSO4
CuCl2
Cu(OH)2
D
Al
Al2(SO4)3
AlCl3
NaAlO2
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
下列说法正确的是
A.所含质子数和电子数相等的粒子一定是原子
B.具有相同核电荷数的原子或简单的离子,一定是同种元素
C.质量数相同的原子其化学性质一定相同
D.两种粒子如果核外电子排布相同,化学性质就一定相同
难度: 简单查看答案及解析
-
2017年5月9日,最新发现的第113号、115号、117号和118号元素终于有了中文名称

根据元素周期律知识,下列预测或说法肯定不合理的是( )
A.Nh的最高价氧化物对应的水化物的化学式为H3NhO3是一种强酸
B.Mc的最高价阳离子为Mc5+,氧化性比较弱
C.Og是第七周期中的最后一种元素,其原子序数是所有已发现元素中最大的
D.根据金属和非金属的分界线,Ts的中文名称为“钿”可能更合理
难度: 简单查看答案及解析
-
从下列事实所列出的相应结论正确的是
序号
实验事实
结论
①
SO2使酸性高锰酸钾溶液退色
可证明SO2有漂白性
②
用磨口玻璃瓶保存NaOH溶液,硝酸用棕色试剂瓶保存在阴暗处
都发生了氧化还原反应
③
取少量Na2SO3样品加入Ba(NO3)2溶液后,产生白色沉淀滴加稀盐酸,沉淀不溶解,
证明Na2SO3已氧化变质
④
某溶液加入稀盐酸产生能使澄清石灰水变浑浊的无色无味气体,该溶液滴加CaCl2溶液,有白色沉淀生成
确定该溶液存在CO32-
⑤
某无色溶液中加入浓氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝
该溶液一定有NH4+
A.①② B.③④⑤ C.②④ D.④⑤
难度: 中等查看答案及解析
-
一定量的SO2与NaOH溶液反应,所得产物中含有Na2SO3和NaHSO3,物质的量之比为3:5,则参加反应的SO2与NaOH的物质的量之比为
A.1:2 B.3:5 C.8:11 D.18:8
难度: 中等查看答案及解析
-
实验室以空气和镁为原料制备 Mg3N2 的装置如图所示(夹持和加热装置略去):
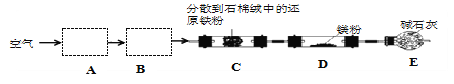
下列说法正确的是( )
A.装置 A、B 中可依次加入浓硫酸、NaOH 溶液
B.若去掉装置 C,对产品纯度无影响
C.实验时应先加热 C,通入一段时间空气后再加热D
D.E 中碱石灰的作用是吸收尾气
难度: 中等查看答案及解析
-
化学反应中,有时存在“一种物质过量,另一种物质仍不能完全反应”的特殊情况。下列反应中属于这种情况的是( )
①过量的Zn与18 mol·L-1硫酸溶液反应 ②过量的氢气与少量的氮气在催化剂存在和一定条件下充分反应 ③过量的二氧化锰与浓盐酸 ④过量的铜与浓硫酸 ⑤过量的铜与稀硝酸 ⑥ 过量的稀硫酸与块状石灰石 ⑦常温下过量浓硫酸与铝
A.②③⑤ B.②③④⑥⑦
C.①④⑤ D.①②③④⑤
难度: 困难查看答案及解析
-
(变式探究)在含有a g HNO3的稀硝酸中,加入b g铁粉充分反应,铁全部溶解并生成NO,有a/4 g HNO3被还原,则a∶b不可能为 ( )
A. 2∶1 B. 3∶1 C. 4∶1 D. 9∶2
难度: 困难查看答案及解析
-
实验室探究SO2与Fe(NO3)3溶液反应的原理,装置如下图,实验中Y装置产生白色沉淀。下列说法不正确的是
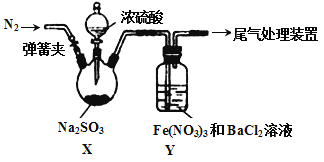
A.滴加浓硫酸之前应进行的操作是打开弹簧夹,通入一段时间N2
B.Y中产生的白色沉淀是BaSO4或BaSO3
C.产生白色沉淀的原因可能是在酸性条件下SO2与NO3- 反应生成了SO42-
D.若将Fe(NO3)3换成FeCl3,Y中也能产生白色沉淀,说明Fe3+也能将SO2氧化
难度: 中等查看答案及解析
-
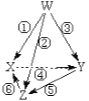
短周期主族元素W、X、Y、Z的原子半径依次增大,X、Y同主族,且X、Y原子序数之和是W、Z原子序数之和的2倍。m、n、p、r是由这些元素组成的二元化合物,甲、乙是其中两种元素对应的单质,n与乙在常温下均是淡黄色固体。上述物质间的转化关系如图所示(部分生成物已省略)。下列说法正确的是
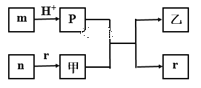
A.简单离子半径大小:X>Y>Z
B.热稳定性:r>p
C.含Y元素的含氧酸一定都是强酸
D.二元化合物n 是碱性氧化物
难度: 中等查看答案及解析
-
两种短周期元素X和Y,可以组成化合物XY3,当Y的原子序数为m时,X的原子序数为
①m- 4 ②m +4 ③m+8 ④m-2 ⑤m +6
A. ①②④⑤ B. ①②③⑤ C. ①②③④ D. ①②③④⑤
难度: 困难查看答案及解析
-
图中曲线表示短周期元素的原子序数(按递增顺序连续排列)及其常见最高化合价的关系,下列叙述不正确的是 ( )
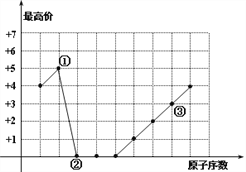
A. 单核简单离子半径大小为:②<③
B. ①、③可以按原子个数比1︰1形成化合物
C. ②、③形成的化合物是两性物质
D. ①、②形成的化合物的摩尔质量可能是44g/mol
难度: 中等查看答案及解析
-
10mLNO、CO2的混合气体通过足量的Na2O2后,气体的体积变为5mL(相同状况),则CO2和NO的体积比不可能为
A. 1∶1 B. 1∶2
C. 2∶1 D. 3∶2
难度: 困难查看答案及解析
-
amol FeS与bmol FeO投入到VL、c mol/L的硝酸溶液中充分反应产生NO气体,所得澄清溶液成分可看作是Fe(NO3)3、H2SO4的混合液,则反应中未被还原的硝酸可能为
( )
①(a+b)×63g ②(a+b)×189g ③(a+b)mol ④
mol
A.①④ B.②③ C.①③ D.②④
难度: 中等查看答案及解析