-
下列除杂试剂或方法正确的是
A. Fe(Al):盐酸 B. FeCl2(FeCl3):铜粉
C. CO2(HCl):饱和Na2CO3溶液 D. Na2CO 3固体(NaHCO3):加热
难度: 中等查看答案及解析
-
下列变化中,气体被还原的是
A. 氨气使酚酞溶液由无色变成红色 B. 二氧化碳使Na2O2由浅黄色变成白色
C. 氧气使FeSO4溶液由浅绿色变成黄色 D. 氢气使灼热的CuO由黑色变成红色
难度: 简单查看答案及解析
-
某溶液中含有大量Fe2+、Al3+、Fe3+、Na+、Cl-、SO42-离子,其中加入足量Na2O2固体后,再加入足量的盐酸溶解沉淀,最后溶液中的离子数目与反应前相比保持不变的是
A.Na+、Fe2+ B.Al3+、SO42- C.Fe3+、SO42- D.Al3+、Cl-
难度: 中等查看答案及解析
-
化学与社会、生产、生活等密切相关,下列说法正确的是
A.制作高压锅的硬铝不属于合金
B.在 “雾霾” 等空气污染的治理方面,化学不能发挥作用
C.氯气、明矾是水处理过程中常用的两种化学试剂,两者的作用原理相同
D.用豆浆可以制作出美味可口的豆腐,属于胶体的聚沉
难度: 简单查看答案及解析
-
下列说法正确的是
A.我国自主研发的“龙芯1号”CPU芯片与光导纤维是同种材料
B.普通玻璃是以纯碱、石灰石和石英砂为原料制备的
C.水晶项链和餐桌上的瓷盘都是硅酸盐制品
D.粗硅制备单晶硅不涉及氧化还原反应
难度: 中等查看答案及解析
-
下列各组物质,按酸、碱、盐、非电解质的顺序排列的是
A.硫酸、纯碱、氯化镁、二氧化碳 B.硝酸、烧碱、干冰、苏打水
C.醋酸、消石灰、明矾、铜 D.盐酸、苛性钠、小苏打、氨气
难度: 中等查看答案及解析
-
下列试剂保存方法错误的是
A.氢氟酸保存在玻璃瓶中
B.钠应保存在石蜡油或煤油中
C.保存FeSO4溶液时加入少量的铁粉
D.NaOH溶液保存在带橡皮塞的玻璃瓶中
难度: 简单查看答案及解析
-
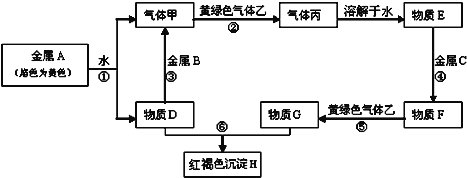
既能通过金属单质与足量
反应得到,也能通过金属单质与酸反应得到的是
A.
B. NaCl C.
D.
难度: 中等查看答案及解析
-
下列离子在溶液中能大量共存的是
A.Na+、OH-、SiO32-、Cl- B.Fe3+、 NH4+、SCN-、Cl-
C.Fe2+ 、H+、Na+ 、MnO4- D.Na+、AlO2-、SO42-、H+
难度: 中等查看答案及解析
-
设NA表示阿伏加德罗常数的值,下列叙述中正确的是
A.常温常压下,等物质的量的N2和CO所含分子数均为NA
B.将含0.l mol FeCl3的饱和溶液制成胶体后,生成的Fe(OH)3胶粒数目为0.1NA
C.常温常压下,lmolNa 加热后生成的Na2O、Na2O2混合物中阴离子数目一定为0.5NA
D.1molFe与足量水蒸气在高温下充分反应后失电子数为NA
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是
A.氯气通入水中,溶液呈酸性:Cl2 + H2O
2H+ + Cl- + ClO-
B.硅酸钠溶液与盐酸混合产生浑浊:SiO32-+2H+=H2SiO3↓
C.向FeBr2溶液中通入少量Cl2:Cl2 +2Br- = 2Cl-+ Br2
D.将磁性氧化铁溶于氢碘酸:Fe3O4+8H+=2Fe3++ Fe2++4H2O
难度: 中等查看答案及解析
-
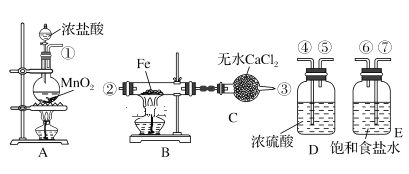
下列实验装置不能达到实验目的的是
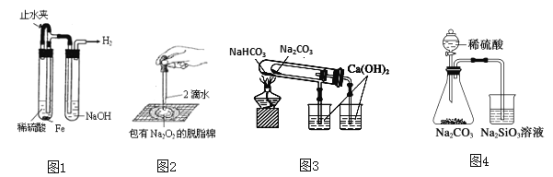
A.图1:制备并观察氢氧化亚铁
B.图2:证明过氧化钠与水反应放热
C.图3:验证NaHCO3和Na2CO3的热稳定性
D.图4:验证酸性强弱H2SO4>H2CO3>H2SiO3
难度: 简单查看答案及解析
-
下列各项操作过程中,发生“先产生沉淀,后沉淀又溶解”现象的是
①向Fe(OH)3胶体中逐滴加入过量的稀硫酸②向AlCl3溶液中通入过量的NH3③向Ca(OH)2溶液中通入过量CO2 ④向NaAlO2溶液中逐滴加入过量的盐酸
A.①② B.①③④ C.①③ D.③④
难度: 简单查看答案及解析
-
下列各组物质中,不满足下图物质间转化关系(物质间的反应均为一步转化)的选项是

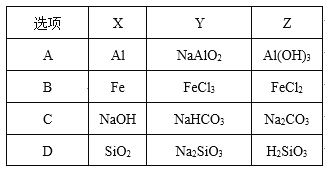
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
高纯度单晶硅是典型的无机非金属材料,又称半导体材料,它的发现和使用曾引起计算机的一场革命,这种材料可以按下列方法制备,下列说法正确的是
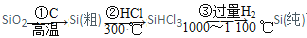
A.二氧化硅的分子式是SiO2
B.步骤①的化学方程式是SiO2 + C
Si + CO2↑
C.步骤③中,每生成1mol Si,转移4mol电子
D.二氧化硅能与氢氟酸发生反应,而硅单质不能与氢氟酸发生反应
难度: 中等查看答案及解析
-
向100mLNaOH溶液中通入一定量的CO2气体,充分反应后,再向所得溶液中逐滴加入0.2mol·L-1的盐酸,产生CO2气体的体积与所加盐酸体积之间的关系如图所示。下列判断正确的是
A.所得溶液溶质成分的物质的量之比为:n(NaHCO3):n(Na2CO3)=2: 1
B.所得溶液溶质成分的物质的量之比为:(NaOH):n(Na2CO3)=1: 3
C.原NaOH溶液的浓度为0.1mol/L
D.通入CO2体积为448mL
难度: 困难查看答案及解析