-
下列电离方程式的书写正确的是( )
A.NaHSO4 = Na+ +HSO4- B.H2CO3
CO32-+2H+
C.CH3COONa
Na+ + CH3COO- D.NH3·H2O
NH4+ + OH-
难度: 简单查看答案及解析
-
有一处于平衡状态的反应:X(s)+3Y(g)
2Z(g);ΔH<0。为了使平衡向生成Z的方向移动,应选择的条件是( )
①高温 ②低温 ③高压 ④低压 ⑤加正催化剂 ⑥分离出Z
A.①③⑤ B.②③⑥ C.②③⑤ D.②④⑥
难度: 简单查看答案及解析
-
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是①CH3OH(g)+H2O(g) = CO2(g)+3H2(g) △H = + 49. 0 kJ·mol-1②CH3OH(g)+
O2(g) = CO2(g)+2H2(g) △H =-192. 9 kJ·mol-1,下列说法正确的是
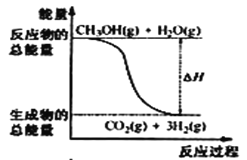
A.CH3OH的燃烧热为192. 9 kJ·mol-1
B.反应①中的能量变化如图所示
C.CH3OH转变成H2的过程一定要吸收能量
D.根据②推知反应:CH3OH(l) +
O2(g) = CO2(g) +2H2(g) △H >-192. 9kJ·mol-1
难度: 中等查看答案及解析
-
常温下,将pH=3的盐酸溶液和pH=11的氨水等体积混和后,溶液中离子浓度关系正确的是
A.c(NH4+)>c(Cl-)> c(H+)> c(OH-)
B.c(NH4+)> c(Cl-)> c(OH-)> c(H+)
C.c(Cl-)> c(NH4+)> c(H+)> c(OH-)
D.c(Cl-)> c(NH4+)> c(OH-)> c(H+)
难度: 中等查看答案及解析
-
下列各组离子在溶液中能大量共存的是( )
A.Na+、NO3-、Al3+、SO42- B.HCO3-、Na+、OH-、Cl-
C.Ag+、Na+、Cl-、K+ D.AlO2-、Cl-、SO42-、Fe3+
难度: 中等查看答案及解析
-
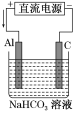
利用如图所示装置可以在铜牌表面电镀一层银。下列有关说法正确的是
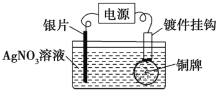
A. 通电后,Ag+向阳极移动
B. 银片与电源负极相连
C. 该电解池的阴极反应可表示为Ag++e-
Ag
D. 当电镀一段时间后,将电源反接,铜牌可恢复如初
难度: 中等查看答案及解析
-
如图是某同学设计的原电池装置,下列叙述中正确的是
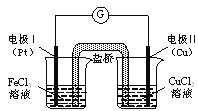
A. 电极Ⅰ上发生还原反应,作原电池的负极
B. 电极Ⅱ的电极反应式为: Cu2++2e-=" Cu"
C. 该原电池的总反应为: 2Fe3++Cu= Cu2++2Fe2+
D. 盐桥中装有含氯化钾的琼脂,其作用是传递电子
难度: 中等查看答案及解析
-
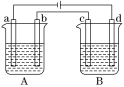
利用下图装置进行实验,开始时,a、b两处液面相平,密封好,放置一段时间。下列说法不正确的是
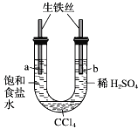
A. a管发生吸氧腐蚀,b管发生析氢腐蚀
B. 一段时间后,a管液面高于b管液面
C. a处溶液的pH增大,b处溶液的pH减小
D. a、b两处具有相同的电极反应式:Fe-2e-=Fe2+
难度: 中等查看答案及解析
-
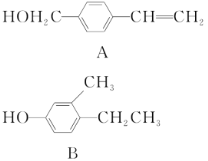
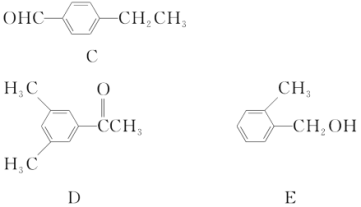
下列说法不正确的是( )
A.O2和O3互为同素异形体
B.
H、
H和
H互为同位素
C.CH2=CH2和
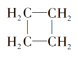 互为同系物
互为同系物D.
和
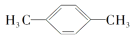 互为同分异构体
互为同分异构体难度: 中等查看答案及解析