-
化学知识广泛应用于生产、生活中,下列叙述不正确的是( )
A.纯碱可以用作锅炉除垢时CaSO4的转化剂
B.“地沟油”禁止食用,但可用于生产肥皂
C.明矾和ClO2均可用作净水剂,且净水原理相同
D.为防止电池中的重金属等污染土壤和水体,应积极开发废电池的综合利用技术
难度: 中等查看答案及解析
-
下列描述中,不符合生产实际的是( )
A.电解熔融的氧化铝制取金属铝,用石墨作阳极
B.当镀锡铁制品的镀层破损时,镀层仍能对铁制品起保护作用
C.电解饱和食盐水制烧碱,用涂镍碳钢网作阴极
D.在海轮外壳镶嵌锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法
难度: 中等查看答案及解析
-
下列关于热化学反应的描述正确的是( )
A.中和热测定时,用铜丝代替玻璃棒搅拌,会使中和热测定的数值偏大
B.1mol甲烷燃烧生成水和二氧化碳所放出的热量是甲烷的燃烧热
C.CO(g)的燃烧热△H=-283.0kJ/mol,则 2CO2(g)=2CO(g)+O2(g)△H=+566.0kJ/mol
D.HCl和NaOH反应的中和热-57.3kJ/mol,则H2SO4和NaOH反应的反应热△H=-114.6kJ/mol
难度: 中等查看答案及解析
-
在一定体积的密闭容器中,进行化学反应:CO2(g)+H2(g)=CO(g)+H2O(g),化学平衡常数(K)和温度(t)的关系如下表:
t/℃
700
800
830
1000
1200
K
0.6
0.9
1.0
1.7
2.6
根据以上信息推断以下说法正确的是( )
A.升高温度,该反应向逆反应方向移动
B.此反应只有达到平衡时,密闭容器中的压强才不会变化
C.该反应在1000℃时的反应速率一定比700℃时大
D.该反应的反应物的转化率越大,化学平衡常数越大
难度: 中等查看答案及解析
-
关于溶液的下列说法不正确的是( )
A.某温度下,向该温度下pH=8的Ba(OH)2溶液中加入等体积pH=4的盐酸,充分反应后,混合溶液的pH=6
B.c(NH4+)相同的三种溶液中:①NH3・H2O②NH4Cl③(NH4)2SO4,溶液浓度大小顺序为①>②>③
C.往0.1mol/LNH4Cl溶液中不断加入NaOH固体,随着NaOH的加入
不断减小
D.一定温度下,氢氧化钙达到溶解平衡,向此溶液中加入少量氧化钙粉末,则溶液中 n(Ca2+)增大
难度: 中等查看答案及解析
-
室温时,向20mL0.1mol/L的醋酸溶液中不断滴加0.1mol/L的NaOH溶液,溶液的pH变化曲线如图所示,在滴定过程中,下列关于溶液中离子浓度关系不正确的是( )
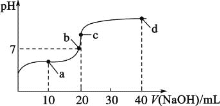
A.a点时:c(CH3COO-)+2c(OH-)=c(CH3COOH)+2c(H+)
B.b点时:c(Na+)=c(CH3COO-)
C.c点时:c(OH-)=c(CH3COOH)+c(H+)
D.d点时:c(Na+ )>c(CH3COO-)>c(OH-)>c(H+)
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.将pH=a的氨水稀释10倍,稀释后c(OH-)是原溶液c(OH-)的
B.NaClO溶液与FeCl2溶液混合发生反应:2ClO-+Fe2++2H2O=2HClO+Fe(OH)2
C.实验室配制氯化铁溶液时,先将固体溶解在浓盐酸中,再稀释至所需浓度
D.在c(CO32-)+c(HCO3-)+c(H2CO3)=c(Na+)的溶液中,有c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)
难度: 中等查看答案及解析
-
可逆反应:2NO2(g)
2NO(g)+O2(g)在可变容积的密闭容器中进行,达到平衡的标志正确的有:( )
①单位时间内反应nmolO2的同时,生成2nmolNO ②容器内总压强不再变化的状态 ③NO2、NO、O2的物质的量浓度为2:2:1的状态 ④混合气体的密度不再改变的状态 ⑤混合气体的颜色不再改变的状态⑥混合气体的平均相对分子质量不再改变的状态
A.2个 B.3个 C.4个 D.5个
难度: 中等查看答案及解析
-
某温度下,在一个2L的密闭容器中,加入4molA和2molB进行如下反应:2A(g)+B(g)=C(s)+3D(g),反应2min后达到平衡,测得生成1.6molC,下列说法不正确的是( )
A.前2minD的平均反应速率为1.2mol/(L•min)
B.此时B的平衡转化率是40%
C.增大该体系的压强,平衡不移动
D.该温度下平衡常数K=432
难度: 中等查看答案及解析