-
已知一定条件下断裂1 mol下列化学键生成气态原子需要吸收的能量如下:H—H 436 kJ;Cl—Cl 243 kJ;H—Cl 431 kJ。下列所得热化学方程式或结论正确的是( )
A.氢分子中的化学键比氯气分子中的化学键更稳定
B.2HCl(g) = H2(g) + Cl2(g)的反应热ΔH<0
C.H2(g) + Cl2(g) = 2HCl(g) ΔH=﹣183 kJ
D.相同条件下,H2(g)+ Cl2(g) =2HCl(g)反应在光照和点燃条件下的ΔH不相等
难度: 中等查看答案及解析
-
一定条件下,在容积为10 L的固定容器中发生反应:N2(g)+3H2(g)
2NH3(g) ΔH<0,反应过程如下图。下列说法正确的是
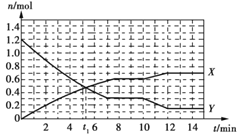
A. t1 min时,正、逆反应速率相等
B. 曲线X表示NH3的物质的量随时间变化的关系
C. 0~8 min,H2的化学反应速率v(H2)=0.75 mol·L-1·min-1
D. 10~12 min,N2的化学反应速率v(N2)=0.25 mol·L-1·min-1
难度: 简单查看答案及解析
-
硫酸工业生产过程中,涉及SO2转化为SO3的反应,某化学研究小组在450 ℃时,在一容积为10 L 的恒容密闭容器中研究该可逆反应:2SO2(g)+O2(g)
2SO3(g),得出的相关数据如表所示:
时间/min
n(SO2)/mol
n(O2)/mol
n(SO3)/mol
0
0.200
0.100
0
10
0.190
0.095
0.010
15
0.160
0.080
0.040
20
0.160
0.080
0.040
25
0.150
0.150
0.050
根据表中数据,下列判断正确的是
A. 0~10 min内的反应速率可表示为v(SO2)=0.010 mol/(L·min)
B. 15~20 min内,正、逆反应速率不相等
C. 工业上常用增加SO2的量来提高O2的转化率
D. 20~25 min内,数据变化的原因可能是增加了O2的物质的量
难度: 中等查看答案及解析
-
根据如图有关图象,说法正确的是( )
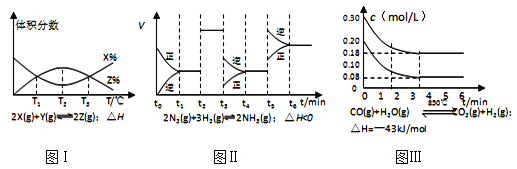
A. 由图Ⅰ知,反应在T1、T3处达到平衡,且该反应的△H<0
B. 由图Ⅱ知,反应在t6时刻,NH3体积分数最大
C. 由图Ⅱ知,t3时采取降低反应体系温度的措施
D. 图Ⅲ表示在10L容器、850℃时的反应,由图知,到4min时,反应放出51.6kJ的热量
难度: 中等查看答案及解析
-
在2L密闭容器中进行反应C(s)+H2O(g)
CO(g)+H2(g)△H>0,测得c(H2O)随反应时间(t)的变化如图。下列判断正确的是
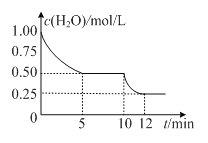
A.5min时该反应的K值一定小于12 min时的K值
B.0~5min内,v (H2)=0.05mol/(L•min)
C.10 min时,改变的外界条件可能是减小压强
D.该反应混合气体的平均相对分子质量:5min时小于12 min 时的
难度: 困难查看答案及解析
-
在恒容密闭容器中存在下列平衡:CO(g)+H2O(g)
CO2(g)+H2(g),CO2的平衡浓度c(CO2)与温度T的关系如图所示。
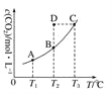
下列说法错误的是
A. 反应CO(g)+H2O(g)
CO2(g)+H2(g)的 ΔH﹥0
B. 在T2时,若反应处于状态D,则一定有ν(正)﹥ν(逆)
C. 平衡状态A与C相比,平衡状态A的c(CO)大
D. 若T1、T2时的平衡常数分别为K1、K2,则K1﹤K2
难度: 中等查看答案及解析
-
下列叙述正确的是
A.强电解质都易溶于水,所以BaSO4是弱电解质
B.一定条件下醋酸溶液的导电能力可能比稀硫酸强
C.SO2的水溶液能导电,所以SO2是电解质
D.金刚石不导电,因此金刚石是非电解质
难度: 简单查看答案及解析
-
某化学反应其△H=﹣198kJ•mol﹣1,△S=348J•mol﹣1•K﹣1,则此反应在下列哪种情况下可自发进行( )
A.仅在低温下自发进行 B.仅在高温下自发进行
C.在任何温度下都不能自发进行 D.在任何温度下都能自发进行
难度: 简单查看答案及解析
-
已知分解1mol H2O2 放出热量98kJ,在含少量I-的溶液中,H2O2的分解机理为:H2O2+I-→H2O+IO- 慢,H2O2+IO-→H2O+O2+I- 快;下列有关反应的说法正确的是( )
A.反应的速率与I-的浓度有关 B.IO-也是该反应的催化剂
C.反应活化能等于98kJ·mol-1 D.v(H2O2)=v(H2O)=v(O2)
难度: 中等查看答案及解析
-
下列关于热化学反应的描述中正确的是( )
A.HCl和NaOH反应的中和热ΔH=-57.3 kJ·mol-1,则H2SO4和Ba(OH)2反应热ΔH=2×(-57.3)kJ·mol-1
B.1 mol甲烷燃烧生成气态水和二氧化碳气体所放出的热量就是甲烷的燃烧热
C.CO(g)的燃烧热是283.0 kJ·mol-1,则2CO2(g)=2CO(g)+O2(g)反应的ΔH=+2×283.0 kJ·mol-1
D.需要加热才能发生的反应一定是吸热反应
难度: 简单查看答案及解析
-
在一定温度下容积不变的容器中能说明反应:C(s) + H2O(g)
CO(g)+H2(g)达到化学平衡状态的是( )
①气体的压强不变 ②每生成n个CO分子同时生成n个H2分子 ③四种物质的分子数之比为1:1:1:1 ④气体的密度不变⑤断裂2n个H-O键同时断裂n个H-H键⑥气体的平均摩尔质量不变
A.①⑤⑥ B.②⑤⑥ C.①④⑤⑥ D.①②④⑤⑥
难度: 中等查看答案及解析
-
醋酸在水中电离方程式可表示为:CH3COOH⇌CH3COO-+H+△H>0,下列操作能使H+浓度增大的是( )
A.加入少量NaOH固体 B.加入固体CH3COONa
C.加入锌粉 D.加热升温10℃
难度: 简单查看答案及解析
-
在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如表:下列说法错误的是:( )
物质
X
Y
Z
初始浓度/
0.1
0.2
0
平衡浓度/
0.05
0.05
0.1
A.反应达到平衡时,X的转化率为50%
B.反应可表示为X+3Y
2Z,其平衡常数为1600
C.改变温度可以改变此反应的平衡常数
D.增压使平衡向生成Z的方向移动,平衡常数增大
难度: 中等查看答案及解析
-
在密闭容器中发生反应:xA(g)+yB(g)
zC(g),平衡时测得A的浓度为0.50 mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度降低为0.30 mol/L,下列有关判断正确的是 ( )
A.x+y<z B.平衡向正反应方向移动
C.B的转化率降低 D.C的体积分数增大
难度: 中等查看答案及解析
-
在一定温度下,反应A2(g)+B2(g)
2AB(g)达到平衡的标志是( )
A.单位时间内生成n molA2同时生成n molAB
B.容器内的总物质的量不随时间变化
C.单位时间内生成2n molAB的同时生成n molB2
D.单位时间内生成n molA2的同时生成n molB2
难度: 简单查看答案及解析