-
下列反应中,既属于氧化还原反应同时又是吸热反应的是( )
A. Ba(OH)2•8H2O与NH4Cl反应 B. 灼热的碳与高温水蒸气的反应
C. 铝与稀盐酸 D. H2与O2的燃烧反应
难度: 简单查看答案及解析
-
下列说法中错误的是
A. 凡是放热反应而且熵增加的反应,就更易自发进行
B. 对于同一物质在不同状态时的熵值是:气态>液态>固态
C. 平衡常数K值越大,则可逆反应进行越完全,反应物的转化率越大
D. 凡是能量达到活化能的分子发生的碰撞均为有效碰撞
难度: 中等查看答案及解析
-
有A、B、C、D四种金属,当A、B组成原电池时,电子流动方向A →B ;当A、D组成原电池时, A为正极;B与E构成原电池时,电极反应式为:E2-+2e-=E,B-2e-=B2+则A、B、D、E金属性由强到弱的顺序为
A. A﹥B﹥E﹥D B. A﹥B﹥D﹥E C. D﹥E﹥A﹥B D. D﹥A﹥B﹥E
难度: 中等查看答案及解析
-
下列热化学方程式书写正确的是(ΔH的绝对值均正确)( )
A.C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(g) ΔH=-1367.0kJ·mol-1(燃烧热)
B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH=+57.3kJ·mol-1(中和热)
C.S(s)+O2(g)=SO2(g) ΔH=-296.8kJ·mol-1(反应热)
D.2NO2=O2+2NO ΔH=+116.2kJ·mol-1(反应热)
难度: 中等查看答案及解析
-
在电解水时,为了增强导电性,加入的电解质最好选用( )
A.Na2SO4 B.CuCl2 C.HCl D.CuSO4
难度: 简单查看答案及解析
-
某学生欲完成反应2Ag+2HCl =2AgCl↓+H2↑,设计了四个实验,你认为可行的是
A.
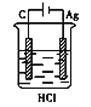 B.
B.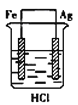 C.
C.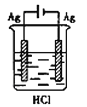 D.
D.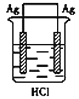
难度: 中等查看答案及解析
-
在四个不同的容器中,在不同的条件下进行合成氨反应,根据下列在相同时间内测得的结果判断,生成氨的反应速率最快的是
A.v(NH3)=0.05 mol/(L•min) B.v(NH3)=0.2 mol/(L•min)
C.v(H2)=0.3 mol/(L•min) D.v(H2)=0.4 mol/(L•min)
难度: 中等查看答案及解析
-
反应C(s)+H2O (g)
CO(g)+H2(g)在一密闭容器中进行,下列条件的改变能加快反应速率是
A.增加C的量 B.将容器的体积缩小一半
C.保持容器体积不变,充入N2 D.保持压强不变,充入He
难度: 中等查看答案及解析
-
对可逆反应4NH3(g)+5O2(g)
4NO(g)+6H2O(g),下列叙述正确的是
A.达到化学平衡时,4v正(O2) = 5v逆(NO)
B.若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态
C.达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大
D.化学反应速率关系是:2v正(NH3) = 3v正(H2O)
难度: 中等查看答案及解析
-
某温度时,N2+3H2
2NH3的平衡常数K=a,则此温度下,NH3
H2+
N2的平衡常数为( )
A.
B.
C.
D.a-2
难度: 简单查看答案及解析
-
下列图示中关于铜电极的连接错误的是
A.铜锌原电池
 B.电解精炼铜
B.电解精炼铜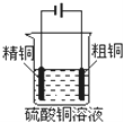
C.镀件上镀铜
 D.电解氯化铜溶液
D.电解氯化铜溶液
难度: 中等查看答案及解析
-
测定稀盐酸和氢氧化钠稀溶液中和热的实验中没有使用的仪器有:①大、小烧杯;②容量瓶;③量筒;④环形玻璃搅拌棒;⑤试管;⑥温度计;⑦蒸发皿;⑧托盘天平中的( )
A. ①②⑥⑦ B. ②⑤⑦⑧ C. ②③⑦⑧ D. ③④⑤⑦
难度: 简单查看答案及解析
-
下列各组热化学方程式中,化学反应的ΔH前者大于后者的是( )
①C(s)+O2(g)= CO2(g)ΔH1;C(s)+
O2(g)= CO(g)ΔH2
②S(s)+O2(g)= SO2(g)ΔH3;S(g)+O2(g)=SO2(g)ΔH4
③H2(g)+
O2(g)=H2O(l)ΔH5;2H2(g)+O2(g)= 2H2O(l)ΔH6
④CaCO3(s)= CaO(s)+CO2(g)ΔH7;CaO(s)+H2O(l)= Ca(OH)2(s)ΔH8
A.① B.④ C.②③④ D.①②③
难度: 中等查看答案及解析
-
把6 mol A气体和5 mol B气体混合充入4 L 密闭容器中,在一定条件下发生反应:3A(g)+B(g)
2C(g)+xD(g),经5 s达到平衡,此时生成C为2 mol ,测得D的平均反应速率为0.1 mol·L-1·s-1,下列说法错误的是( )
A. x=2 B. B的转化率为20%
C. 平衡时A的浓度为0.75 mol·L-1 D. 恒温达到平衡时容器内的压强为开始的75%
难度: 中等查看答案及解析
-
有一种锂水电池,可作为鱼雷和潜艇的储备电源。电池以金属锂和钢板为电极材料,LiOH为电解质,使用时加入水即可放电。关于该电池的说法正确的是( )
A. 放电时电子的流动方向是“正极→导线→负极”
B. 钢板为正极,钢板上发生还原反应
C. 放电过程中OH-向正极做定向移动
D. 总反应:2Li+2H+=2Li++H2↑
难度: 中等查看答案及解析
-
某原电池装置如图所示,电池总反应为2Ag+Cl2=2AgCl。下列说法正确的是

A.正极反应为AgCl +e-=Ag +Cl-
B.放电时,交换膜右侧溶液中有大量白色沉淀生成
C.若用NaCl溶液代替盐酸,则电池总反应随之改变
D.当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少0.02 mol离子
难度: 中等查看答案及解析
-
下列说法或表示方法正确的是
A.凡是放热反应,不需加热即可发生
B.由“C(石墨)=C(金刚石)△H =+1.9kJ/mol”可知,金刚石比石墨稳定
C.在l0lkPa时,2gH2完全燃烧生成液态水放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O⑴:△H =-285.8kJ/mol。
D.在稀溶液中,H+(aq)+OH-(aq)=H2O(l) △H =-57.3kJ/mol,若将含 lmolCH3COOH 与含1mol NaOH的稀溶液混合,放出的热量小于57.3kJ
难度: 中等查看答案及解析
-
可逆反应2NO2(g)
2NO(g)+O2(g)在体积固定的密闭容器中进行,达到平衡状态的标志是
①单位时间内生成1 mol O2的同时生成2 mol NO2
②单位时间内生成1 mol O2的同时生成2 mol NO
③用NO2、NO、O2表示的反应速率之比为2∶2∶1的状态
④混合气体的颜色不再改变的状态 ⑤混合气体的密度不再改变的状态
⑥混合气体的压强不再改变的状态 ⑦混合气体的平均相对分子质量不再改变的状态
A. ①④⑥⑦ B. ②③⑤⑦ C. ①②③④⑤ D. 全部
难度: 中等查看答案及解析
-
在一个定容的密闭容器中进行如下反应:2SO2(g)+O2(g)
2SO3(g)。已知反应过程中的某一时间SO2、O2和SO3的浓度分别为0.1 mol·L-1、0.05 mol·L-1和0.3 mol·L-1。当反应达平衡时不可能存在的数据正确的是
A. c(SO2)=0.25 mol·L-1 B. c(O2)=0.12 mol·L-1
C. c(SO2)+c(SO3)=0.15 mol·L-1 D. c(SO3)+c(O2)=0.3 mol·L-1
难度: 中等查看答案及解析
-
分析如图所示的四个原电池装置,其中结论正确的是
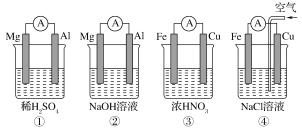
A. ①②中Mg作负极,③④中Fe作负极
B. ②中Mg作正极,正极反应式为6H2O+6e-==6OH-+3H2↑
C. ③中Fe作负极,电极反应式为Fe-2e-==Fe2+
D. ④中Cu作正极,电极反应式为2H++2e-==H2↑
难度: 中等查看答案及解析
-
如图所示,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中,下列分析正确的是
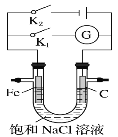
A.K1闭合,铁棒上发生的反应为2H++2e-=H2↑
B.K1闭合,石墨棒周围溶液pH逐渐升高
C.K2闭合,铁棒不会被腐蚀,属于牺牲阳极的阴极保护法
D.K2闭合,电路中通过0.002NA个电子时,两极共产生0.001 mol气体
难度: 中等查看答案及解析
-
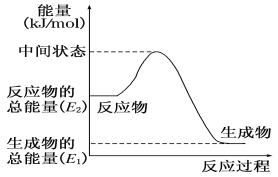
2SO2(g)+O2(g)
2SO3(g)反应过程中的能量变化如图所示(图中E1表示无催化剂时正反应的活化能,E2表示无催化剂时逆反应的活化能)。下列有关叙述不正确的是
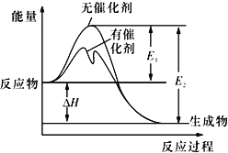
A. 该反应的逆反应为吸热反应,升高温度可提高活化分子的百分数
B. 500℃、101kPa下,将1molSO2(g)和0.5molO2(g)置于密闭容器中充分反应生成SO3(g)放热akJ,其热化学方程式为2SO2(g)+O2(g)
2SO3(g) ΔH=-2a kJ·mol-l
C. 该反应中,反应物的总键能小于生成物的总键能
D. ΔH=E1-E2,使用催化剂改变活化能,但不改变反应热
难度: 困难查看答案及解析
-
镉镍可充电电池的充、放电反应按下式进行:Cd+2NiO(OH)+2H2O
Cd(OH)2+2Ni(OH)2,由此判断,下列说法错误的是
A. 放电时,NiO(OH)作正极
B. 放电时,Cd发生还原反应
C. 电解质溶液为碱性溶液
D. 充电时,阳极反应为Ni(OH)2+OH--e-== NiO(OH)+H2O
难度: 中等查看答案及解析
-
三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。下列叙述正确的是( )

A. 通电后中间隔室的SO42-离子向正极迁移,正极区溶液碱性增强
B. 该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品
C. 阴极区溶液pH降低,阳极区溶液pH升高
D. 当电路中通过1mol电子的电量时,会有0.5mol的O2生成
难度: 简单查看答案及解析