-
甲醇是人们开发和利用的一种新能源.
已知:①2H2(g)+O2(g)═2H2O(l)△H1=﹣571.8kJ/mol;
②CH3OH(g)+ O2(g)═CO2(g)+2H2(g)△H2=﹣192.9kJ/mol.
O2(g)═CO2(g)+2H2(g)△H2=﹣192.9kJ/mol.
(1)甲醇蒸气完全燃烧的热化学反应方程式为 .
(2)反应②中的能量变化如图所示,则△H2= kJ/mol.
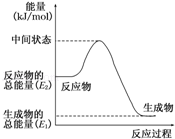
(3)H2(g)的燃烧热为 .
(4)请你分析H2(g)作为能源比甲醇蒸气作为能源的优点: 、 (写出两点即可).
-
甲醇是人们开发和利用的一种新能源。已知:
①2H2(g)+O2(g)===2H2O(l) △H2=-571.8 kJ/mol;
②CH3OH(g)+1/2O2(g)===CO2(g)+2H2(g) △H2=-192.9 kJ/mol。
(1)甲醇蒸气完全燃烧的热化学反应方程式为__________________________。
(2)反应②中的能量变化如图所示,则△H2=_______kJ/mol(用E1、E2表示)。
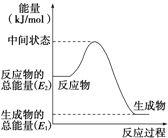
(3)H2(g)的燃烧热为_______。
(4)请你分析H2(g)作为能源比甲醇蒸气作为能源的优点:______(写出两点即可)。
-
甲醇是人们开发和利用的一种新能源。已知:
①2H2(g)+O2(g)===2H2O(l) ΔH1=-571.8kJ/mol;
②CH3OH(g)+1/2O2(g)===CO2(g)+2H2(g) ΔH2=-192.9kJ/mol
(1)甲醇蒸气完全燃烧的热化学方程式为_____________________________。
(2)反应②中的能量变化如图所示,则ΔH2=_________________________。
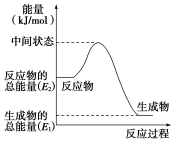
(3)H2(g)的燃烧热为____________________。
-
甲醇是人们开发和利用的一种新能源。已知:
①2H2(g)+O2(g)=2H2O(l) ΔH1=-571.8 kJ/mol;
②CH3OH(l)+ O2(g)=CO2(g)+2H2(g) ΔH2=-192.9 kJ/mol
O2(g)=CO2(g)+2H2(g) ΔH2=-192.9 kJ/mol
(1)表示甲醇完全燃烧热的的热化学方程式为________________;
(2)反应②中的能量变化如图所示,则ΔH2=__________。(用E1、E2的相关式子表示);
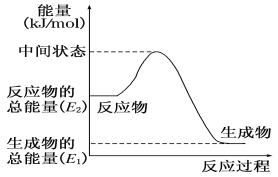
(3)捕碳技术(主要指捕获CO2在降低温室气体排放中具有重要的作用。目前NH3和(NH4)2CO3已经被用作工业捕碳剂,它们与CO2可发生如下反应:
反应Ⅰ:2NH3(l)+H2O(l)+CO2(g) (NH4)2CO3(aq) △H1
(NH4)2CO3(aq) △H1
反应Ⅱ:NH3(l)+H2O(l)+CO2(g) NH4HCO3(aq) △H2
NH4HCO3(aq) △H2
反应Ⅲ: (NH4)2CO3(aq)+H2O(l)+CO2(g) 2NH4HCO3(aq) △H3
2NH4HCO3(aq) △H3
则ΔH3与ΔH1 、ΔH2与之间的关系为ΔH3 = _________ ;
(4)拆开1mol气态物质中某种共价键需要吸收的能量叫键能。从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程。在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量:
| 化学键 | H﹣H | N﹣H | N≡N |
| 键能/kJ/mol | 436 | 391 | 945 |
已知反应N2(g)+3H2(g) 2NH3(g) ΔH=akJ/mol,试根据表中所列键能数据估算a的值______。(注明“+”或“﹣”)。
2NH3(g) ΔH=akJ/mol,试根据表中所列键能数据估算a的值______。(注明“+”或“﹣”)。
-
甲醇是人们开发和利用的一种新能源。
已知①2H2(g)+O2(g)===2H2O(l)ΔH1=-571.8 kJ/mol;
②CH3OH(g)+1/2O2(g)===CO2(g)+2H2(g)ΔH2=-192.9 kJ/mol。
(1)甲醇蒸气完全燃烧的热化学反应方程式_______。
(2)反应②中的能量变化如图所示,则ΔH2=________ kJ/mol(用E1、E2表示)。
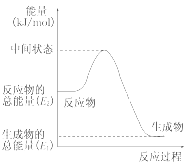
(3)H2(g)的燃烧热为________,分析H2(g)作为能源比甲醇蒸气作为能源的优点:_______________________________________________(写出两点即可)
-
(8分)甲醇是人们开发和利用的一种新能源。已知:
①2H2(g)+O2(g)===2H2O(l) ΔH1=-571.8 kJ·mol-1;
②CH3OH(g)+1/2O2(g)===CO2(g)+2H2(g) ΔH2=-192.9 kJ·mol-1
(1)甲醇蒸气完全燃烧的热化学方程式为______________________________。
(2)反应②中的能量变化如图所示,则ΔH2=__________________。
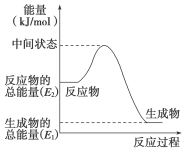
(3)H2(g)的燃烧热为________________。
(4)请你分析H2(g)作为能源比甲醇蒸气作为能源的优点:
_____________________________________;________________________________(写出两点即可)。
-
甲醇是人们开发和利用的一种新能源。已知:
①2H2(g)+O2(g)=2H2O(l) △H1=-571.8kJ· mol-1
②CH3OH(g)+ O2(g)=CO2(g)+2H2(g) △H=-192.9 kJ· mol-1
O2(g)=CO2(g)+2H2(g) △H=-192.9 kJ· mol-1
(1)甲醇蒸汽完全燃烧的热化学方程式为_____________。
(2)反应②中的能量变化如下图所示,则△H2=______(用E1和E2表示)。

(3)H2(g)的燃烧热为__________ kJ· mol-1。
(4)请你分析H2(g)作为能源比甲醇蒸汽作为能源的优点:__________________(写出一点)
-
(8分)甲醇是人们开发和利用的一种新能源。已知:
①2H2(g)+O2(g)===2H2O(l) ΔH1=-571.8 kJ/mol;
②CH3OH(g)+1/2O2(g)===CO2(g)+2H2(g) ΔH2=-192.9 kJ/mol。
(1)甲醇蒸气完全燃烧的热化学反应方程式为__________________________。
(2)反应②中的能量变化如图所示,则ΔH2=________ kJ/mol(用E1、E2表示)。
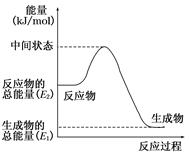
(3)H2(g)的燃烧热为________。
(4)请你分析H2(g)作为能源比甲醇蒸气作为能源的优点:______(写出两点即可)。
-
甲醇是人们开发和利用的一种新能源。已知:
①2H2(g)+O2(g)===2H2O(l) ΔH1=-571.8 kJ·mol-1;
②CH3OH(g)+1/2O2(g)===CO2(g)+2H2(g) ΔH2=-192.9 kJ·mol-1
(1)甲醇蒸气完全燃烧的热化学方程式为_____________________________________
(2)反应②中的能量变化如图所示,则ΔH2=__________。(用E1、E2的相关式子表示)
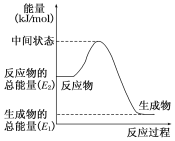
(3)H2(g)的燃烧热为________。
(4)请你分析H2(g)作为能源比甲醇蒸气作为能源的优点:________________(写出两点即可)。
-
甲醇是人们开发和利用的一种新能源。已知:
① 2H2(g)+O2(g) =2H2O(l) ΔH1=-571.8 kJ·mol-1;
② CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g) ΔH2=-192.9 kJ·mol-1
(1)甲醇蒸气完全燃烧的热化学方程式为____________。
(2)反应②中的能量变化如右图所示,则ΔH2=_______________。(填字母表达式)
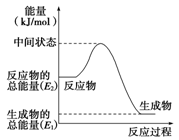
(3)H2(g)的燃烧热为 。
O2(g)=CO2(g)+2H2(g) ΔH2=-192.9 kJ/mol

(NH4)2CO3(aq) △H1
NH4HCO3(aq) △H2
2NH4HCO3(aq) △H3
2NH3(g) ΔH=akJ/mol,试根据表中所列键能数据估算a的值______。(注明“+”或“﹣”)。








