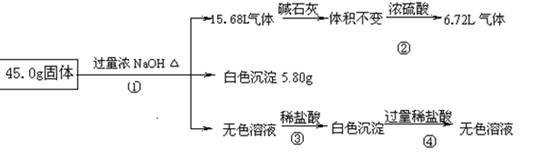
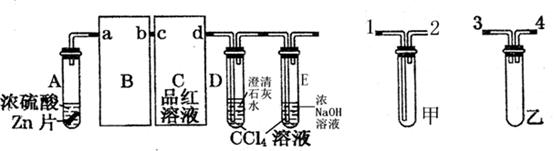
-
以下非金属氧化物与其引起的环境问题及主要来源对应正确的是
氧化物
环境问题
主要来源
A
CO
煤气中毒
含碳燃料的不完全燃烧
B
SO2
光化学烟雾
汽车尾气的排放
C
NO2
温室效应
工厂废气的排放
D
CO2
酸雨
化石燃料的燃烧
难度: 中等查看答案及解析
-
前几年俄罗斯科学家宣布用核反应得到了113号和115号两种新元素,质量数分别是284和288。下列关于这两种元素原子的说法正确的是
A.质子数相等 B.中子数相等
C.电子数相等 D.中子数和核外电子数之差相等
难度: 中等查看答案及解析
-
过氧乙酸是在抗SARS病毒期间常使用的一种高效杀毒剂,其分子式为C2H4O3,它具有氧化性,漂白作用,下列物质中漂白作用原理与过氧乙酸不同的是
A.氯水(次氯酸) B.臭氧 C.活性炭 D.过氧化钠
难度: 中等查看答案及解析
-
下列说法正确的是
A.按分散剂种类可将分散系分为溶液、胶体和浊液
B. 漂白粉、钢、氯水、Fe(OH)3胶体均为混合物
C. CO2、SO3、NO2和水反应均能生成相应的酸,都属于酸性氧化物
D. KNO3溶液、铜、熔融的NaCl均能导电,都属于电解质
难度: 中等查看答案及解析
-
下列说法中正确的是
A.合金的熔点一般比组成合金的各成分金属高
B.玻璃、陶瓷、水泥都是常见的硅酸盐材料
C.玻璃钢是由玻璃纤维和钢组成的复合材料
D.光导纤维的主要成分是硅,可广泛用于通信和医疗领域
难度: 中等查看答案及解析
-
下列实验现象或描述正确的是
A. 向新制氯水中滴加少量紫色石蕊试液,充分振荡后溶液呈红色
B. 铜在氯气中燃烧生成蓝色烟
C. 二氧化硅不与任何酸反应,可用石英制造耐酸容器
D. 明矾[KAl(SO4)2·12H2O]在水中能形成Al(OH)3胶体,可用作净水剂
难度: 中等查看答案及解析
-
实验室中以下物质的贮存方法不正确的是
A.浓硝酸用带橡胶塞的细口、棕色试剂瓶盛放,并贮存在阴凉处
B.少量金属钠保存在煤油中
C.少量液溴可用水封存,防止溴挥发
D.保存硫酸亚铁溶液时,要向其中加入少量硫酸和铁粉
难度: 中等查看答案及解析
-
用NA表示阿伏伽德罗常数,下列说法正确的是
A.0.2 mol H2O2完全分解转移的电子数为0.4NA
B.含NA个Na+的Na2O溶于1L水中,Na+的物质的量浓度为1mol·L-1]
C.在标准状况下,2.8g N2和2.24LCO所含电子数均为1.4NA
D. 2.24L SO2与O2混合气体中所含氧原子数为0.2NA
难度: 中等查看答案及解析
-
在下列各组离子中能大量共存的是
A. K+、ClO-、SO42-、H+ B. K+、H+、NO3-、Fe2+
C. Na+、CO32-、Cl-、Ca2+ D. Na+、Cl-、SO42-、H+
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是
A.用稀氢氧化钠吸收氯气:2OH-+Cl2=Cl-+ClO-+H2O
B.用浓盐酸与MnO2反应制取少量氯气:MnO2+2H++2Cl-
Mn2++Cl2↑+H2O
C.向碳酸氢钠溶液中加入氢氧化钠:HCO3-+ OH-=CO2↑+H2O
D.用氢氧化钠溶液除去铝表面的氧化膜:Al(OH)3+OH-=[Al(OH)4] -
难度: 中等查看答案及解析
-
下列各项操作中发生先沉淀后溶解现象的是
①向饱和碳酸钠溶液中通入过量的CO2 ②向Fe(OH)3胶体中逐滴滴加入过量H2SO4
③向Ba(NO3)2溶液中通入过量SO2 ④向石灰水中通入过量CO2
⑤向硅酸钠溶液中逐滴加入过量的盐酸
A. ①②④ B.②③⑤ C.②④ D. ①③⑤
难度: 中等查看答案及解析
-
某同学弄清楚喷泉实验的原理后,有了一个创新的想法,如果改换一下烧瓶内的气体,以及胶头滴管和烧杯内的液体,也应该可以做喷泉实验。他用课本上所用的装置实际做了一下,果真得到了美丽的喷泉。下列组合中不可能是该同学设计的组合的是
A氯化氢和水 B.氧气和水 C.二氧化碳和NaOH溶液 D.氯气和NaOH溶液
难度: 中等查看答案及解析
-
实验室欲用碳酸钠固体配制500mL、0.10mol·L-1的Na2CO3溶液,下列叙述正确的是
A.实验用到的仪器有:托盘天平、烧杯、500mL容量瓶、玻璃棒
B.将称量好的固体放入500mL容量瓶中溶解
C.定容时若俯视刻度,则所得溶液浓度偏高
D.定容后翻转摇匀,发现液面下降,又加入蒸馏水到刻度线
难度: 中等查看答案及解析
-
把0.6mol铜粉投入含0.8mol硝酸和0.2mol硫酸的稀溶液中,则标准状况下放出的气体的物质的量为
A.0.2 mol B.0.3 mol C.0.4 mol D.0.5mol
难度: 中等查看答案及解析
-
为提纯下列物质(括号内的物质是杂质),所选用的除杂试剂和分离方法都正确的是
被提纯的物质
除杂试剂
分离方法
A
溴化钠溶液(NaI)
氯水、CCl4
萃取、分液
B
氯化铵溶液(FeCl3)
氢氧化钠溶液
过滤
C
二氧化氮(NO)
氧气
通入过量O2
D
碳酸氢钠溶液(碳酸钠)
二氧化碳
向溶液中通入过量CO2
难度: 中等查看答案及解析
-
已知A、B、C均为短周期的元素,A、B同周期,A、C的最低价离子分别为A2- 和C-,B2+和C-具有相同的电子层结构,下列说法正确的是
A.离子半径:A2->C->B2+
B.C元素的最高正价一定为+7价
C.对应气态氢化物的稳定性A>C
D.还原性:A2-<C-
难度: 中等查看答案及解析
-
Na2FeO4是一种高效多功能水处理剂,应用前景广阔。一种制备Na2FeO4的方法可用化学方程式表示如下:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,对此反应下列说法中正确的是
A.Na2O2在反应中只作氧化剂
B.O2是还原产物
C. 2molFeSO4发生反应时,反应中共有8mol电子转移
D. Na2FeO4既是氧化产物又是还原产物
难度: 中等查看答案及解析
-
下列实验过程中产生的现象与对应的图形正确的是
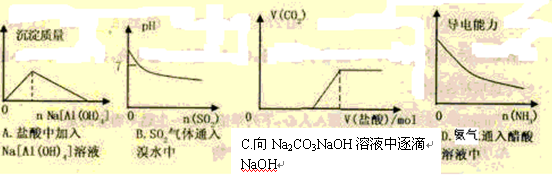
难度: 中等查看答案及解析