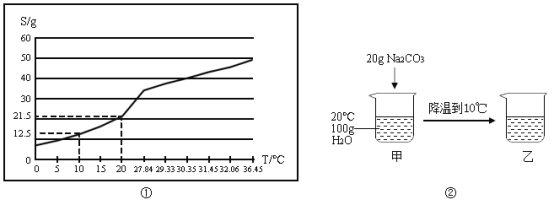
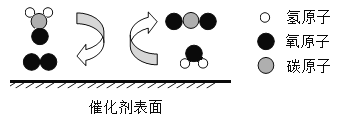
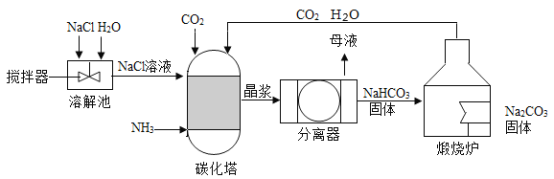
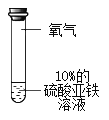
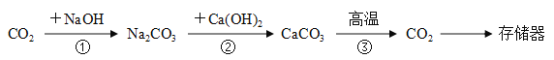-
下列物质与水混合,能形成溶液的是
A.碳酸钙 B.植物油 C.奶粉 D.食盐
难度: 简单查看答案及解析
-
铜可用于制造传统的炭火锅,下列性质与此用途无关的是

A.熔点高 B.导热性好
C.延展性好 D.导电性好
难度: 中等查看答案及解析
-
下列物质在氧气中燃烧,产生大量白烟的是
A.红磷 B.铁丝 C.木炭 D.蜡烛
难度: 简单查看答案及解析
-
下列物质中,属于单质的是
A.CO2 B.H2SO4 C.Fe D.KCl
难度: 简单查看答案及解析
-
下列物质,不能与盐酸发生反应的是
A.碳酸钙 B.金属银 C.氢氧化钠 D.氧化铁
难度: 简单查看答案及解析
-
铁元素是人体必需微量元素,缺铁会导致
A.佝偻病 B.贫血 C.坏血病 D.骨质疏松
难度: 简单查看答案及解析
-
下列物质与水混合,不会有明显放热现象的是
A.浓硫酸 B.食盐 C.生石灰 D.氢氧化钠
难度: 简单查看答案及解析
-
下列有关物质的用途,利用其物理性质的是
A.氧气用于急救病人 B.生石灰用作食品干燥剂
C.干冰用于人工降雨 D.小苏打用于治疗胃酸过多
难度: 简单查看答案及解析
-
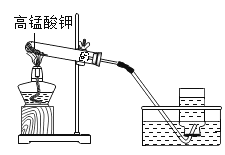
关于电解水的实验。下列说法正确的是
A.该实验所用的水越纯净越好
B.正负两极的气体体积比为2:1
C.该实验说明水由氢原子和氧原子构成
D.通过该实验可确定水由氢元素和氧元素组成
难度: 简单查看答案及解析
-
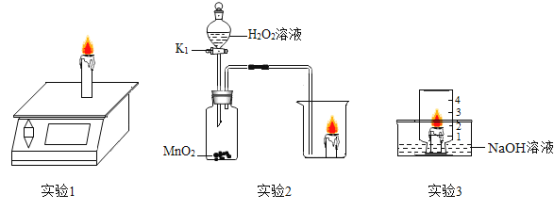
依据氧气、二氧化碳的性质判断,下列做法能达到目的的是
A.
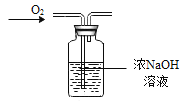 干燥O2 B.
干燥O2 B. 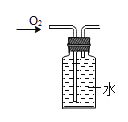 收集O2
收集O2C.
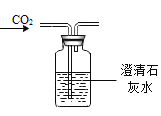 检验CO2 D.
检验CO2 D. 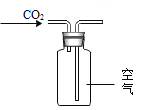 收集CO2
收集CO2难度: 简单查看答案及解析
 稀释浓硫酸 B.
稀释浓硫酸 B.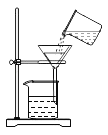 过滤
过滤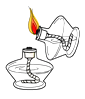 点燃酒精灯 D.
点燃酒精灯 D.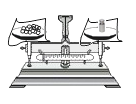 称量NaCl固体
称量NaCl固体