-
与化学相关的知识常见于中国传统文化典籍之中。下列有关说法不正确的是( )
A. “熬胆矾铁釜,久之亦化为铜”,该过程发生了置换反应
B. 某古剑“以剂钢为刃,铁为茎干……”,“剂钢”指的是铁的合金
C. 《梦溪笔谈》载:“高奴县出脂水,燃之如麻,但烟甚浓。”所述“脂水”属于石油
D. 《肘后备急方》载:“青蒿一握,以水二升渍,绞取汁”。此提取青蒿素的方法属蒸馏
难度: 简单查看答案及解析
-
某固体由Ba2+、Cu2+、Na+、Cl-、CO32-、SO42-中的几种离子构成,取一定质量的该固体样品,进行如下实验:
①将固体溶于水得无色透明溶液,加入足量BaCl2溶液,过滤后得到5克白色沉淀。
②在沉淀中加入过量稀硝酸,仍有3克白色沉淀。
③在滤液中滴加AgNO3溶液,产生白色沉淀。则该固体中一定含有
A. Na+、CO32-、SO42- B. Cu2+、CO32-、SO42-
C. Cl-、CO32-、SO42- D. Na+、Ba2+、Cl-
难度: 困难查看答案及解析
-
下列各组溶液,不用其它试剂就不能鉴别出来的是( )
A.NaOH、NaCl 、HNO3 、FeCl3
B.BaCl2、MgSO4、KNO3、NaOH
C.CuCl2、HCl、NaNO3、AgNO3
D.HCl、H2SO4、Na2CO3、Ba(NO3)2
难度: 中等查看答案及解析
-
SO2是造成酸雨的主要气体之一,其水溶液叫亚硫酸(H2SO3)溶液。H2S是一种具有臭鸡蛋气味 的剧毒气体,其水溶液叫氢硫酸溶液。已知相同的条件下,氢硫酸的酸性弱于亚硫酸。室温下,向饱和的亚硫酸溶液中通入过量的硫化氢气体,发生反应如下:
。则下图中溶液的 pH 随通入硫化氢体积的变化曲线示意图正确的是( )
A.
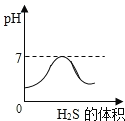
B.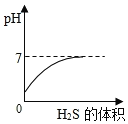
C.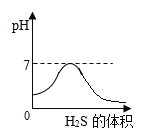
D.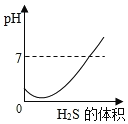
难度: 简单查看答案及解析
-
1~18 号元素中 X 元素的原子核外只有 1 个电子,Y 元素的原子的第三层有 6 个电子,Z 元素的第 二层有 6 个电子。下列说法正确的是( )
A.X2Y 和 X2Z 的混合物 pH>7
B.X2YZ4 与氯化钡溶液反应的沉淀可做钡餐
C.YZ2 的大量排放引起温室效应
D.X2Z 和 X2Z2 中 Z 的化合价都是-2
难度: 简单查看答案及解析
-
某粗盐样品中含有可溶性的氯化镁、氯化钙杂质和不溶性的泥沙。常温下,将140g该粗盐样品溶解于水中,过滤得到不足3g泥沙和1000g溶液。取出500g溶液进行测定,其中含有镁元素1.2g,钙元素2g,氯元素42.6g。则粗盐中氯化钠的质量分数约为( )
A.86.3% B.88.1% C.83.6% D.91.6%
难度: 困难查看答案及解析
-
由C、H两种元素组成的化合物叫烃,碳原子数不大于4的烃在常温常压下通常为气体,常温常压时烃C2H4和另一种烃组成的混合气体中碳元素的质量分数为87%,则另一种烃可能是( )
A.CH4 B.C2H2 C.C2H6 D.C8H8
难度: 简单查看答案及解析
-
在一密闭容器中发生某反应,其中甲、乙、丙、丁四种物质的质量变化如表所示,下列判断不正确的是( )
物质
甲
乙
丙
丁
反应前质量(g)
10
16
0
0
反应中质量(g)
m2
1.6
反应后质量(g)
m1
0
15.2
6.4
A.m1的值是4.4 B.m2的值是4
C.甲和乙是反应物 D.甲、丁间反应的质量比为7:8
难度: 困难查看答案及解析
-
某材料只含金属镁和铝,课外小组为测定该材料中Mg的含量做了如下实验:取102g材料完全溶于盐酸得到溶液,将溶液分成两等份,向其中一份中逐渐加入NaOH固体,NaOH固体与溶液中产生沉淀的质量关系如图所示,则该材料中Mg的质量分数为( )
已知:
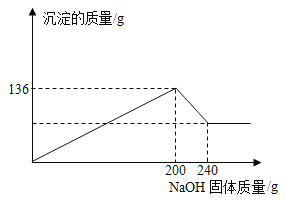
A.23.53% B.42.65% C.21.32% D.47.06%
难度: 困难查看答案及解析