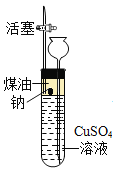
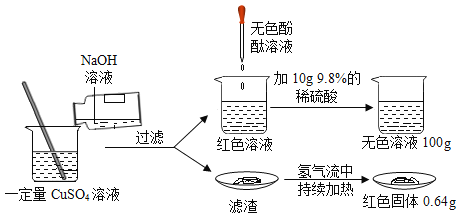
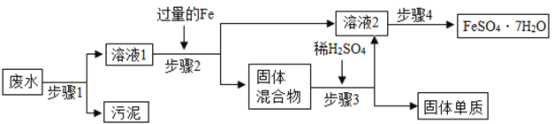
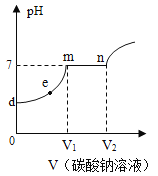
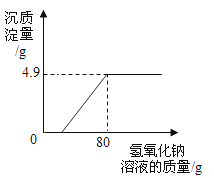
-
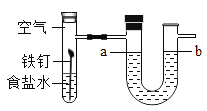
已知同温、同压下相同体积的任何气体都含有相同的分子数.工业制HNO3的尾气中含有的NO2和NO常用NaOH溶液吸收,反应的化学方程式为:NO+NO2+2NaOH=2NaNO2+H2O,2NO2+2NaOH=NaNO2+NaNO3+H2O,NO不能被NaOH溶液吸收.同温、同压下NO2与NO的体积比如下,其中不能被NaOH溶液完全吸收的是( )
A. 1:1 B. 1:3 C. 2:l D. 3:1
难度: 困难查看答案及解析
-
下列物质属于混合物的是( )
A.水银 B.液氮 C.干冰 D.生铁
难度: 简单查看答案及解析
-
某种新型药物的化学式为C5H4N3O2F,下列关于这种药物的说法中正确的是( )
A.这种药物是混合物
B.这种药物中碳元素和氢元素的质量比为5 : 4
C.这种药物中含有2个氢分子
D.这种药物由碳、氢、氮、氧、氟五种元素组成
难度: 简单查看答案及解析
-
配制一定溶质质量分数的氯化钠溶液,下列操作中有错误的是:( )
A.
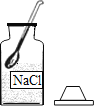 取出NaCl B.
取出NaCl B. 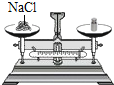 称量NaCl
称量NaClC.
 量取水 D.
量取水 D. 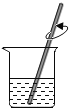 溶解NaCl
溶解NaCl难度: 简单查看答案及解析
-
下列选项中物质的名称、俗名、化学式、类别、用途完全对应的是( )
A.碳酸钠 石碱
碱 制玻璃
B.氧化钙 熟石灰
氧化物 补钙剂
C.硫酸铜 胆矾
酸 制农药
D.氢氧化钠 苛性钠
碱 人造棉
难度: 简单查看答案及解析
-
下图是一定条件下某反应的微观模拟示意图,按图分析下列说法错误的是
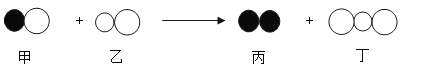
A.反应前后,原子种类、数目不变
B.该反应中的甲、乙、丙、丁四种物质的分子个数比为2:2:1:2
C.该反应是置换反应
D.反应物和生成物都是由分子构成的
难度: 困难查看答案及解析
-
现有等质量甲、乙、丙三种金属,分别放入三份溶质质量分数相同的足量稀硫酸中,产生氢气的质量与反应时间的关系如下图所示(已知甲、乙、丙在生成物中化合价均为+2价)。则下列说法中不正确的是( )
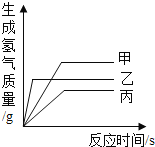
A.生成氢气的质量:甲﹥乙﹥丙 B.消耗硫酸的质量:甲﹥乙﹥丙
C.金属活动性:乙﹥甲﹥丙 D.消耗金属的质量:乙﹥甲﹥丙
难度: 困难查看答案及解析
-
下图是甲、乙两种固体物质的溶解度曲线,下列说法正确的是
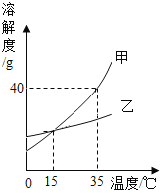
A.15℃时,甲和乙的饱和溶液中溶质质量相等
B.35℃时,30g甲加入50g水中,得到80g甲溶液
C.从乙溶液中获得乙晶体,常用蒸发结晶的方法
D.降低温度,甲溶液中溶质的质量分数一定减小
难度: 中等查看答案及解析
-
有一包白色固体样品,可能由CaCO3、NaOH、MgCl2、Na2SO4和BaCl2中的一种或几种物质组成,为探究该样品的组成,某小组取适量样品按下列流程进行实验。
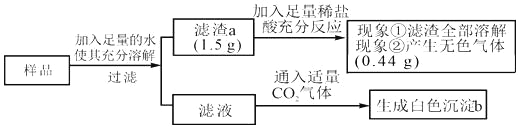
下列判断正确的是( )
A. 原固体样品中一定有CaCO3、NaOH、MgCl2、BaCl2,可能有Na2SO4
B. 滤液中溶质的成分是NaOH、BaCl2
C. 滤渣a的成分是CaCO3
D. 若现象①“滤渣全部溶解”变为“滤渣部分溶解”,其他现象不变,则原样品中仍能确定是否存在MgCl2
难度: 困难查看答案及解析