-
天然气的主要成分CH4也是一种会产生温室效应的气体,对于相同分子数的CH4和CO2,CH4产生的温室效应更明显.下面是有关天然气的几种叙述;①天然气与煤、柴油相比是较清洁的能源;②等质量的CH4和CO2产生的温室效应也是前者明显;③燃烧天然气也是酸雨的成因之一.其中正确的是( )
A. ①和② B. 只有① C. 只有③ D. ①②③
难度: 中等查看答案及解析
-
下列有关物质分类或归类正确的一组是( )
①液氨、液氧、干冰、氯化银均为化合物
②氢硫酸、盐酸、双氧水、氨水均为混合物
③明矾、小苏打、纯碱、硫酸铜晶体均为盐
④碘酒、牛奶、豆浆、食醋均为溶液
⑤Na2O2、Na2CO3、NaHCO3、Na2SiO3均为钠盐
A.①和②
B.②和③
C.③和④
D.②③⑤
难度: 简单查看答案及解析
-
某同学利用锌、氧化铜和稀硫酸制取铜,他设计了两套方案,方案Ⅰ:利用锌与足量稀硫酸反应制氢气,氢气还原氧化铜;方案Ⅱ:氧化铜溶于稀硫酸生成硫酸铜,然后用锌与硫酸铜反应制备铜。下列关于方案Ⅰ和Ⅱ的评价不正确的是( )
A.方案Ⅱ比方案Ⅰ操作简便
B.等质量的锌,相同条件下在方案Ⅰ和方案Ⅱ中制得的铜的质量相同
C.等质量的H2SO4参加反应,方案Ⅰ制取铜的质量比方案Ⅱ的少
D.为了加快锌与稀硫酸反应,可以在溶液中加入少量氧化铜
难度: 中等查看答案及解析
-
从某些性质看:NH3和H2O,NH4+和H3O+,NH2-和OH-,N3-和O2-两两相似,据此判断下列反应:①
②
③
④
其中正确的是( )
A.③
B.②
C.②③
D.①②③④
难度: 简单查看答案及解析
-
下列各组物质间不能通过一步反应就能实现如图转化的是( )
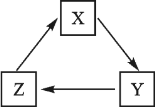
X
Y
Z
A
H2SO4
HCl
H2O
B
CuSO4
CuCl2
Cu(OH)2
C
CaCO3
CO2
K2CO3
D
Ca(OH)2
NaOH
Mg(OH)2
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
用化学方法鉴别下列各组物质时,所需试剂最少的是( )
A.稀盐酸、稀硫酸、稀硝酸、氢氧化钾
B.氢氧化钠溶液、氢氧化钡溶液、硝酸钙溶液、无色酚酞
C.氯化钠溶液、碳酸钠溶液、氯化钙溶液、硫酸钠溶液
D.碳酸钠稀溶液、稀盐酸、氢氧化钡溶液、氯化钾溶液
难度: 中等查看答案及解析
-
M、N两种物质的溶解度曲线如图所示。t2℃时往一杯100g水中加入质量都是ag的M和N两种物质(假设两种物质的溶解性互不影响),制成混合物。将该混合物的温度降低到tl℃,下列说法正确的是( )
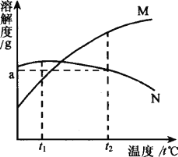
A.t2℃温度下,得到的溶液中溶质M、N的质量分数都为a%
B.温度降低到t1℃时,溶液中两种物质均饱和
C.如果温度升高,溶液中将析出N的晶体,溶质M的质量分数保持不变,溶质N的质量分数将减小
D.温度降到t1℃时,溶液中N的质量分数大于M的质量分数
难度: 中等查看答案及解析
-
如图利用培养皿探究氨气的性质。实验时向NaOH固体上滴几滴浓氨水,将产生氨气。立即用另一表面皿扣在上面。下表中对实验现象所做的解释正确的是( )

选项
实验现象
解释
①
浓盐酸附近产生白烟
NH3与HCl反应生成了NH4Cl固体
②
浓硫酸附近无明显现象
NH3与浓硫酸不发生反应
③
氯化物溶液中有红褐色沉淀
该溶液一定有FeCl3溶液
④
干燥的红色石蕊试纸不变色,湿润的红色石蕊试纸变蓝
NH3是一种可溶性碱
A.②③④
B.①③④
C.①③
D.③④
难度: 简单查看答案及解析
-
已知铜、铁均能与FeCl3溶液反应,
,
。现将铜、铁混合粉末加入到盛有FeCl3溶液的烧杯中,充分反应后烧杯中仍有少量固体,有关烧杯中物质组成的说法正确的是( )
A.溶液中一定含有FeCl3,固定一定有Cu,可能有Fe
B.溶液中一定含有FeCl2,固体一定含Cu
C.溶液中一定含有FeCl2、CuCl2,固体一定含有Cu
D.溶液一定含有FeCl2,固体一定是Fe和Cu
难度: 困难查看答案及解析
-
工业上可利用黄铁矿(主要成分是Fe2S)煅烧的产物冶炼铁和生产硫酸,其反应方程如下:
①
②
③
④
下列说法不正确的是( )
A.反应①②③均有元素化合价发生变化
B.反应①②不属于四种基本反应类型中的任何一种,反应③④属于化合反应
C.将100g蒸馏水加入100g98%的浓硫酸中,可配制200g质量分数为49%的稀硫酸
D.将5gSO3溶于95g水形成溶液,其溶液中溶质的质量分数大于5%
难度: 中等查看答案及解析
-
已知A、B、C、D、E分别是初中化学常见的五种不同类别的物质,其中B的固体和E的浓溶液常用作实验室的干燥剂。F是常见的一种红棕色物质。它们之间存在如图所示的关系(图中“—”表示两端的物质能反应,“→”表示物质间存在转化关系,部分物质和反应条件未标出)。下列说法错误的是( )
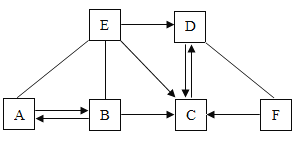
A.A物质可能是碳酸钠或者碳酸氢钠
B.C物质一定条件下也可以转化为B物质或E物质
C.F转化为C不一定是置换反应
D.图中一共11个反应,至少有4个反应为复分解反应
难度: 困难查看答案及解析