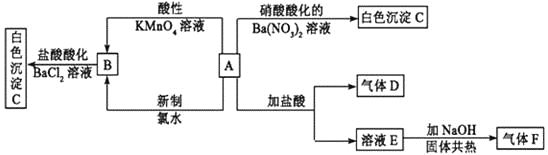
-
硼纤维具有较好的耐热性和弹性,不与氯气、水反应,可与某些金属制成新型材料。在1200℃~1300℃时,氯化硼(BCl3)蒸气与干燥、纯净的氢气反应可制得硼和氯化氢。下列说法不正确的是
A. 含硼纤维的材料可能具有耐热性 B. 氯化硼可能与水反应
C. 该反应中只有两种物质为气态 D. 该反应需要在隔绝空气的条件下进行
难度: 困难查看答案及解析
-
实验室常利用以下反应制取少量氮气:NaNO2+NH4Cl=NaCl+N2↑+2H2O,关于该反应的下列说法正确的是( )
A.NaNO2是氧化剂
B.每生成1mol N2时,转移电子的物质的量为6mol
C.NH4Cl中的氮元素被还原
D.N2既是氧化剂,又是还原剂
难度: 简单查看答案及解析
-
下列反应的离子方程式书写正确的是
A.氯化铝溶液中加入过量氨水:Al3+ + 4NH3•H2O = AlO2- + 4NH4+ + 2H2O
B.澄清石灰水与少量小苏打溶液混合:Ca2+ + OH- + HCO3- = CaCO3↓ + H2O
C.碳酸钙溶于醋酸CaCO3 + 2H+ = Ca2+ + CO2↑ + H2O
D.向NaHSO4溶液加入Ba(OH)2溶液至中性:H++ SO42-+Ba2++OH-=BaSO4↓+ H2O
难度: 中等查看答案及解析
-
有关Na2CO3和NaHCO3的性质,下列叙述中错误的是( )
A. 相同温度下,等浓度的Na2CO3溶液和NaHCO3溶液的碱性比较,前者更强
B. 常温时溶解度:Na2CO3>NaHCO3,且溶于水时均放热
C. 在酒精灯加热的条件下,前者不分解,后者分解
D. 将澄清的石灰水分别加入Na2CO3和NaHCO3溶液中,都产生白色沉淀
难度: 中等查看答案及解析
-
核电站发生爆炸,释放出大量放射性物质,下列图标警示的是放射性物品的是
A.
 B.
B. C.
C. D.
D.
难度: 简单查看答案及解析
-
已知NA为阿伏加德罗常数的数值,下列说法正确的是
A. 56g铁在足量氧气中燃烧,转移的电子数为2NA
B. 1g氢气含有NA个氢气分子
C. 标准状况下,22.4L水含有1mol水分子
D. 2mol钠与过量稀盐酸反应生成NA个氢气分子
难度: 困难查看答案及解析
-
实验室常用王水(浓硝酸和浓盐酸按体积比1:3的混合物)来溶解白金等贵金属进行科学实验。王教授用质量分数为63%的浓硝酸(密度1.40g/
)和质量分数为36.5%的浓盐酸(密度1.19g/
)来配制王水600毫升,假设忽略两种酸混合时的体积变化也不考虑混合后的化学变化,下列说法错误的是
A.该王水中硝酸的物质的量浓度是3.5mol/L
B.该王水中氧元素的质量是100.8g
C.该王水的密度约为1.24g/
D.该王水中HCl的质量分数约为26.2%
难度: 中等查看答案及解析
-
将1.12 g铁粉加入25 mL 2mol/L的氯化铁溶液中,充分反应后,其结果是
A. 铁有剩余,溶液呈浅绿色,Cl- 浓度基本不变
B. 往溶液中滴入无色KSCN溶液,显黄色
C. 氧化产物与还原产物的物质的量之比为2∶5
D. Fe2+和Fe3+的物质的量之比为6∶1
难度: 中等查看答案及解析
-
下列叙述中不正确的是
A.Na2O2是淡黄色固体,Na2O是白色固体,二者与水反应都能生成NaOH
B.CO2能和Na2O2发生反应生成O2,Na2O2既是氧化剂,又是还原剂
C.lmol H2充分燃烧后,产物被Na2O2完全吸收,Na2O2固体增重18g
D.120℃时,0.5mol CO2和水蒸气的混合气体与足量Na2O2充分反应后,剩余气体质量为8g
难度: 中等查看答案及解析
-
下列说法正确的是 ( )
A.擦去铝表面的氧化膜的铝箔,在酒精灯上灼烧时,熔化的铝会滴落下来
B.Al2O3可通过分解反应制得
C.可以用铝制器皿长时间盛放酸性、碱性或咸的食物
D.火灾现场有大量钠存放时,应用泡沫灭火器灭火
难度: 中等查看答案及解析
-
一定能在下列溶液中大量共存的离子组是 ( )
A. 与铝片反应放出氢气的溶液:Na+、NH4+、HCO3-、SO42-
B. 使紫色石蕊试液变红色的溶液:Na+、Cu2+、Cl-、NH4+
C. 0.1 mol/L AgNO3溶液:K+、H+、Cl-、SO42-
D. 0.1 mol/L Na2CO3溶液:K+、Ba2+、NO3-、Cl-
难度: 中等查看答案及解析
-
在氯水中存在多种分子和离子,它们在不同的反应中表现各自的性质。下列实验现象和结论一致且正确的是
A.加入有色布条,一会儿有色布条褪色,说明溶液中有Cl2存在
B.溶液呈黄绿色,且有刺激性气味,说明有HClO分子存在
C.加入AgNO3溶液产生白色沉淀,说明有Cl-分子存在
D.加入NaOH溶液,氯水黄绿色消失,说明有HClO分子存在
难度: 中等查看答案及解析
-
下列装置及药品和实验室制备的气体相匹配的是( )
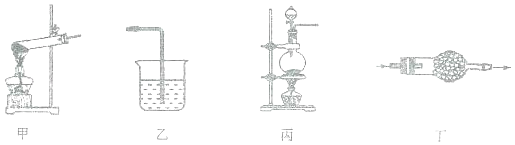
A.甲装置用来制备氧气 B.乙装置用来尾气处理氯化氢气体
C.丙装置用来制取氯气 D.丁装置中盛有碱石灰用来干燥二氧化碳气体
难度: 简单查看答案及解析
-
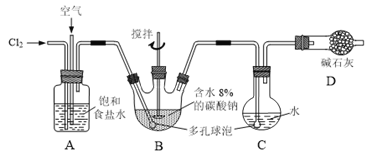
常温常压下,将C12缓慢通入100 mL水中至饱和,然后向所得饱和氯水中逐滴加入0.1 mol·L-1 NaOH溶液,整个过程溶液中H+的浓度变化如图所示。(已知常温常压下C12溶于水时,只有部分C12会和水发生反应)下列叙述正确的是

A.①处溶液的酸性比②处溶液的酸性强
B.依据②处c(H+)可计算溶解的C12的物质的量
C.整个实验过程中,溶液的颜色先变深后变浅,最后变为无色
D.④处表示C12与NaOH溶液恰好完全反应,共转移了0.1mol电子
难度: 中等查看答案及解析
-
下列说法正确的是
A.铜与氯气反应时,剧烈燃烧并产生蓝色的烟
B.将金属钠投入硫酸铜溶液中可观察到有红色的铜生成
C.生活中常用的 “84” 消毒液中的有效成分是NaCl
D.次氯酸不如次氯酸盐稳定,故通常用次氯酸盐作为漂白剂和消毒剂的主要成分
难度: 简单查看答案及解析
-
根据Cl2 通入不同溶液(或水)中的实验现象,所得结论不正确的是
选项
溶液(或水)
现象
结论
A
蒸馏水
溶液呈浅黄绿色
氯水中存在Cl2分子
B
品红溶液
溶液褪色
Cl2有漂白性
C
AgNO3溶液
产生白色沉淀
氯水中存在Cl-
D
Na2S溶液
产生淡黄色沉淀
Cl2有氧化性
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
如图所示实验装置,烧瓶内充满氯气,底部有一层细沙(不参与反应),玻璃导管下口b处塞有一小块钠。从a口伸入一根细铁丝把钠块捅下去,再用滴管从a口滴下一滴水,恰好落在钠块上,立即剧烈反应。下列对此实验的说法中,不正确的是()
A.所充氯气应用向上排空气法收集
B.反应中,烧瓶内产生大量白色烟雾
C.玻璃导管只起到定位加入钠和水的作用
D.烧瓶中Cl2,可能参与四个氧化还原反应
难度: 中等查看答案及解析
-
下列关于氯水的叙述, 正确的是( )
A.新制氯水中只含Cl2和H2O分子 B.新制氯水只能使蓝色石蕊试纸变红但不褪色
C.氯水经光照有气泡逸出,该气体是 HCl D.氯水放置数天后 pH 将变小
难度: 中等查看答案及解析
-
常温下,发生下列几种反应:
①16H++10Z-+2XO4-===2X2++5Z2+8H2O
②2A2++B2===2A3++2B-
③2B-+Z2===B2+2Z-
根据上述反应,判断下列结论错误的是( )
A. 溶液中可发生:Z2+2A2+===2A3++2Z- B. 氧化性强弱的顺序为XO4->Z2>B2>A3+
C. Z2在①③反应中为氧化剂 D. 反应③中B2是2B-的氧化产物
难度: 困难查看答案及解析
-
下列有关实验操作、现象和解释或结论都正确的是
选项
实验操作
现象
解释或结论
A
过量的Fe粉中加入稀HNO3,充分反应后,滴入KSCN溶液
溶液呈红色
稀HNO3将Fe氧化为Fe3+
B
Al箔插入稀HNO3
无现象
Al箔表面被HNO3氧化,形成致密的氧化膜
C
用玻璃棒蘸取浓氨水点到红色石蕊试纸上
试纸变蓝色
浓氨水呈碱性
D
浓HNO3加热
有红棕色气体
HNO3有强氧化性
A.A B.B C.C D.D
难度: 中等查看答案及解析