-
如下图所示(B中冷却装置未画出),将氯气和空气(不参与反应)以体积比约1:3混合通入含水8%的碳酸钠中制备Cl2O,并用水吸收Cl2O制备次氯酸溶液。
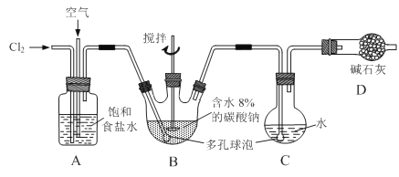
已知:Cl2O极易溶于水并与水反应生成HClO;Cl2O的沸点为3.8℃,42℃以上分解为Cl2和O2。
(1)①实验中控制氯气与空气体积比的方法是_____________________。
②为使反应充分进行,实验中采取的措施有___________________________。
(2)①写出装置B中产生Cl2O的化学方程式:_________________________。
②若B无冷却装置,则进入C中的Cl2O会大量减少。其原因是_____________________。
(3)装置C中采用棕色圆底烧瓶是因为______________________。
(4)已知次氯酸可被H2O2、FeCl2等物质还原成Cl-。测定C中次氯酸溶液的物质的量浓度的实验方案为:用酸式滴定管准确量取20.00 mL次氯酸溶液,________。(可选用的试剂:H2O2溶液、FeCl2溶液、AgNO3溶液。除常用仪器外须使用的仪器有:电子天平,真空干燥箱)
-
如下图所示(B中冷却装置未画出),将氯气和空气(不参与反应)以体积比约1:3混合通入含水8%的碳酸钠中制备Cl2O,并用水吸收Cl2O制备次氯酸溶液。
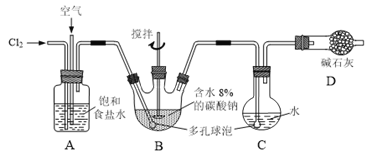
已知:Cl2O极易溶于水并与水反应生成HClO;Cl2O的沸点为3.8℃,42℃以上分解为Cl2和O2。
(1)①实验中控制氯气与空气体积比的方法是______。
②为使反应充分进行,实验中采取的措施有______。
(2)①写出装置B中产生Cl2O的化学方程式并用单线桥法标出电子转移的方向和数目:______。
②若B无冷却装置,则进入C中的Cl2O会大量减少。其原因是______。
(3)装置C中采用棕色圆底烧瓶是因为______。
(4)已知次氯酸可被H2O2、FeCl2等物质还原成Cl-。测定C中次氯酸溶液的物质的量浓度的实验方案为:用酸式滴定管准确量取20.00 mL次氯酸溶液,______。(可选用的试剂:H2O2溶液、FeCl2溶液、AgNO3溶液。除常用仪器外须使用的仪器有:电子天平,真空干燥箱)
-
将氯气和空气(不参与反应)混合通入含水8%的碳酸钠中可以制备Cl2O气体,同时生成CO2。已知Cl2O易溶于水并与水反应生成HClO,现用下列装置制备 Cl2O,并用水吸收Cl2O(不含Cl2)制备次氯酸溶液。

(1)各装置的连接顺序为→→→C→_____________;
(2)写出 A 中反应的化学方程式_______________________________;
(3)装置 C 的作用是_____________;
(4)制备 Cl2O 的氧化还原反应中,Cl2的作用是_____________;
(5)已知次氯酸可被H2O2、FeCl2等物质还原成Cl-。测定E中次氯酸溶液的物质的量浓度的实验方案为:取20.00 mL次氯酸溶液,加入足量的_____________,再加入足量的_____________,过滤,洗涤沉淀,在真空干燥箱中干燥,用电子天平称量沉淀质量为a g,则E中次氯酸的浓度为_____________mol·L-1。 (可选用的试剂:H2O2溶液、FeCl2溶液、AgNO3溶液)。
-
常温常压下,一氧化二氯(Cl2O)为棕黄色气体,沸点为3.8 ℃,42 ℃以上会分解生成Cl2和O2,Cl2O易溶于水并与水反应生成HClO。
(制备产品)将氯气和空气(不参与反应)按体积比1∶3混合通入含水8%的碳酸钠中制备Cl2O,并用水吸收Cl2O(不含Cl2)制备次氯酸溶液。
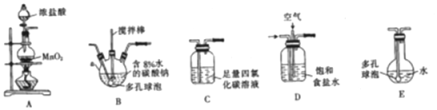
(1)各装置的连接顺序为______→ → →C→ 。
(2)装置B中多孔球泡和搅拌棒的作用是____________________________________ ;装置C的作用是_____________________。
(3)制备Cl2O的化学方程式为________________________。
(4)反应过程中,装置B需放在冷水中,其目的是_____________________________。
(5)此方法相对于用氯气直接溶于水制备次氯酸溶液有两个主要优点,分别是_______。
-
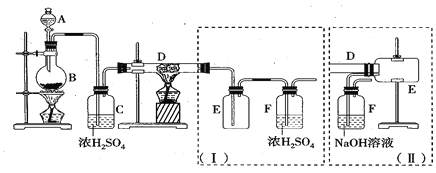
无水三氯化铁呈棕红色,易潮解,100℃左右时升华,冷却后易凝华。下图是两名学生设计的用氯气与铁反应制备无水三氯化铁的实验装置。左边的反应装置相同,而右边的产品收集装置则不同,分别如(Ⅰ)和(Ⅱ)所示。试回答:
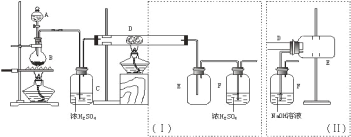
(1)A仪器的名称是_____________________;
(2)B中反应的离子方程式为______________________;其中浓盐酸表现出________性;若用含有0.2 mol HCl的浓盐酸与足量的MnO2反应制取Cl2,制得的Cl2体积总是小于1.12 L(标准状况)的原因是______________。
(3)气体通过装置C的目的是________________。
(4)D中的反应开始前,需进行的操作是___________,应采取的方法是__________________。
(5)D中发生反应的化学方程式为__________________________________________。
(6)装置(Ⅰ)的主要缺点是_______________________________________________。
(7)装置(Ⅱ)中F中发生反应的化学方程式为___________________________。如果选用(Ⅱ)装置来完成实验,则必须采取的改进措施是__________________________。
-
无水三氯化铁呈棕红色,易潮解,100℃左右时升华,冷却后易凝华。下图是两名学生设计的用氯气与铁反应制备无水三氯化铁的实验装置。左边的反应装置相同,而右边的产品收集装置则不同,分别如(I)和(II)所示。试回答:
(1)A仪器的名称是_____________________;
(2)B中反应 离子方程式为______________________;其中浓盐酸表现出的性质为________;若用含有0.2 mol HCl的浓盐酸与足量的MnO2反应制取Cl2,制得的Cl2体积总是小于1.12 L(标准状况)的原因是______________;
离子方程式为______________________;其中浓盐酸表现出的性质为________;若用含有0.2 mol HCl的浓盐酸与足量的MnO2反应制取Cl2,制得的Cl2体积总是小于1.12 L(标准状况)的原因是______________;
(3)气体通过装置C 目的是________________;
目的是________________;
(4)D中的反应开始前,需进行的操作是___________,应采取的方法是__________________;
(5)写出最佳方法鉴别D中产物的离子方程式:__________________________________________;
(6)装置(I)的主要缺点是_______________________________________________;
(7)如果选用(II)装置来完成实验,则必须采取的改进措施是__________________________。
-
某同学设计了有关氯气的实验:
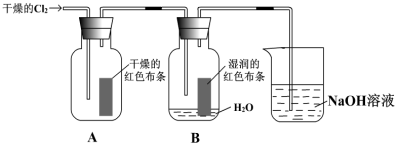
(1)写出实验室制备Cl2的离子方程式,并用单线桥分析电子的转移: 。
(2)装置中通入Cl2后,集气瓶 A中干燥的红色布条无变化,集气瓶B中湿润的红色布条 ,用发生反应的化学方程式和必要的文字叙述解释现象 。
(3)上述装置烧杯中盛放溶液的作用是_________________________。
(4)Fe在Cl2中燃烧,生成棕红色的烟,其溶液中存在Fe3+,向溶液中加入适量量铜粉恰好完全反应,溶液变色,发生的化学反应方程式为 ,后再加氯水,溶液颜色再次发生变化,原因是(用离子方程式表示)_____________。
-
下图为实验室制取纯净、干燥的Cl2,并进行检验Cl2性质实验的装置。其中E瓶中放有干燥红色布条;F中为铜网,F右端出气管口附近放有脱脂棉。

(1)写出制备氯气的反应方程式并用双线桥标明电子转移过程___________。
(2)C中试剂是_______;D中试剂的作用是_________。
(3)E中现象是_____________;F中现象是________;H中发生反应的化学方程式为___________________。
(4)KMnO4与浓盐酸反应也能产生氯气,请配平以下方程式:
____KMnO4 + ____HCl=____KCl + ____MnCl2 + ____Cl2↑ + ____H2O。
若反应产生0.1 mol Cl2,则转移的电子数目为_______。
-
氯气的用途非常广泛。实验室用如下装置制取氯气,并用制取氯气进行性质探究实验。回答下列问题:
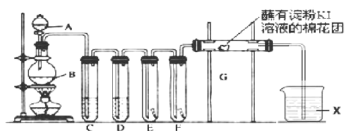
(1)A中盛有浓盐酸,B中盛有 ,写出反应的离子方程式__________________。
,写出反应的离子方程式__________________。
(2)E中为红色干布条,F中为红色湿布条,对比E和F中观察现象的差异可得出的结论是__________________。
(3)试管C和D中试剂名称各为_____________________。X试剂的作用是______________。
(4)装置G处发生反应的离子方程式为_____________________________。
(5)家庭中常用消毒液(主要成分 )与洁厕灵(主要成分盐酸)清洁卫生。某品牌消毒液包装上说明如下图。
)与洁厕灵(主要成分盐酸)清洁卫生。某品牌消毒液包装上说明如下图。

①“与洁厕灵同时使用”会产生有毒氯气,写出反应的离子方程式____________。
②需“密闭保存”的原因_________________________________。
-
氯气的用途非常广泛。实验室用如下装置制取氯气,并用制取氯气进行性质探究实验。回答下列问题:
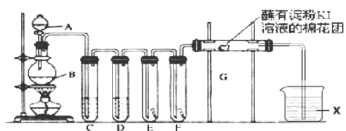
(1)A中盛有浓盐酸,B中盛有 ,写出反应的离子方程式__________________。
,写出反应的离子方程式__________________。
(2)E中为红色干布条,F中为红色湿布条,对比E和F中观察现象的差异可得出的结论是__________________。
(3)试管C和D中试剂名称各为_____________________。X试剂的作用是______________。
(4)装置G处发生反应的离子方程式为_____________________________。
(5)家庭中常用消毒液(主要成分 )与洁厕灵(主要成分盐酸)清洁卫生。某品牌消毒液包装上说明如下图。
)与洁厕灵(主要成分盐酸)清洁卫生。某品牌消毒液包装上说明如下图。

①“与洁厕灵同时使用”会产生有毒氯气,写出反应的离子方程式____________。
②需“密闭保存”的原因_________________________________。











