-
下列变化中,属于化学变化的是( )
A. 干冰升华 B. 纸张燃烧 C. 铜丝折弯 D. 酒精挥发
难度: 简单查看答案及解析
-
下列化肥中,属于磷肥的是( )
A.氯化钾 B.尿素 C.过磷酸钙 D.氯化铵
难度: 简单查看答案及解析
-
下列物质由分子构成的是( )
A.氨气 B.氯化钠 C.镁 D.金刚石
难度: 简单查看答案及解析
-
下列图示实验操作中,正确的是( )
A.
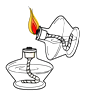 点燃酒精灯 B.
点燃酒精灯 B.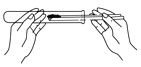 取用碳酸钠
取用碳酸钠C.
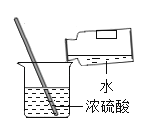 稀释浓硫酸 D.
稀释浓硫酸 D.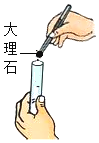 加入大理石
加入大理石难度: 简单查看答案及解析
-
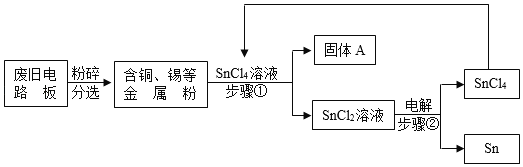
下图为某化学反应的微观模拟示意图,下列有关该反应的说法中,不正确的是
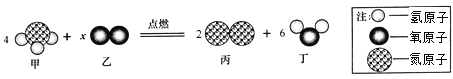
A. 反应前后氮元素的化合价发生改变 B. 该反应属于置换反应
C. 参加反应的甲、乙两物质的质量比为17:24 D. 图示中x的值为2
难度: 中等查看答案及解析
-
净化水的以下操作,其中净化程度最高的是( )
A.过滤 B.沉淀 C.蒸馏 D.吸附
难度: 简单查看答案及解析
-
标准汽油是由异辛烷和正庚烷组成的混合物,其中异辛烷的化学式是C8H18,有关异辛烷的描述错误的是( )
A.异辛烷是由碳元素和氢元素组成
B.异辛烷的相对分子质量为114
C.异辛烷分子是由8个碳原子和18个氢原子构成
D.异辛烷中碳元素的质量分数为84.2%
难度: 简单查看答案及解析
-
下列实验操作中(括号内为待检验物质或杂质),不能达到实验目的的是( )
选项
物质
目的
主要实验操作
A
CO和CO2
区分
将气体分别通入澄清石灰水中,观察现象
B
MnO2和KCl
分离
溶解、过滤、洗涤固体并烘干;蒸发滤液
C
(NH4)2SO4固体(Na2SO4固体)
鉴别
分别加入熟石灰研磨,闻气味
D
HCl(H2SO4)
除杂
加入过量的BaCl2溶液,过滤
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
甲、乙两种固体物质的溶解度曲线如图所示,从中获取的信息正确的是( )

A.甲的溶解度大于乙的溶解度
B.20℃时甲、乙的饱和溶液中溶质的质量分数相等
C.20℃时甲的饱和溶液升温至40℃,溶液中溶质的质量分数增大
D.降低温度可使乙的不饱和溶液变为饱和溶液
难度: 简单查看答案及解析
-
下列各组物质,不能按照关系图(“→”表示反应一步完成)相互转化的是( )
选项
物质
x
y
z
A
B
C
D
A.A B.B C.C D.D
难度: 困难查看答案及解析