-
下列说法正确的是
A.新型冠状病毒在相对封闭的环境中存在经气溶胶传播的可能
B.燃煤中加入CaO可以减少酸雨的形成及温室气体的排放
C.脂肪在胆汁的作用下水解
D.“绿色化学”的核心是应用化学原理对环境污染进行治理
难度: 简单查看答案及解析
-
下列推论中正确的是
A.由Cl2能置换出Br2证明非金属性Cl>Br,由工业制粗硅的反应也能证明非金属性C>Si
B.乙醇能被过量酸性高锰酸钾氧化成乙酸,则乙二醇也能被过量酸性高锰酸钾氧化成乙二酸
C.Al3+与S2-在溶液中可发生相互促进的水解反应生成沉淀和气体,Fe2+与S2-也是如此
D.浓硫酸可以干燥氯化氢气体,则也能干燥氟化氢气体
难度: 困难查看答案及解析
-
短周期主族元素R、X、Y 、Z的原子序数依次增大,化合物M、N均由这四种元素组成,且M的相对分子质量比N小16。分别向M和N中加入烧碱浓溶液并加热,二者均可产生使湿润的红色石蕊试纸变蓝的气体。下列说法错误的是
A.X 形成的某阳离子X5+中每个X都达到8电子结构
B.M和N可能发生反应
C.R与Y形成的具有漂白性的物质和Y与Z形成的具有漂白性的物质等物质的量混合后漂白性增强
D.X和Z的最简单气态氢化物之间反应能生成两种盐
难度: 困难查看答案及解析
-
下列有关同分异构体的叙述正确的是
A.C4H10的二氯代物有8种
B.甲苯与氢气充分加成后的产物的一溴代物有4种
C.分子式为C10H12O2的芳香化合物属于酯类且苯环上有四个取代基的有6种
D.分子式为C5H10并能使溴的四氯化碳溶液褪色的有机物(不含立体异构)有6种
难度: 中等查看答案及解析
-
如图装置可用于收集气体并验证其某些化学性质能达到目的是
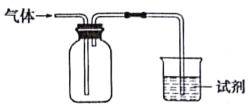
选项
气体
试剂
现象
结论
A
NH3
酚酞试液
溶液变红色
氨水显碱性
B
Cl2
紫色石蕊试液
溶液先变红后褪色
Cl2有酸性和漂白性
C
C2H4
溴水
溶液褪色
C2H4分子中含碳碳双键
D
X
KI淀粉溶液
溶液变蓝
X可能是NO2
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
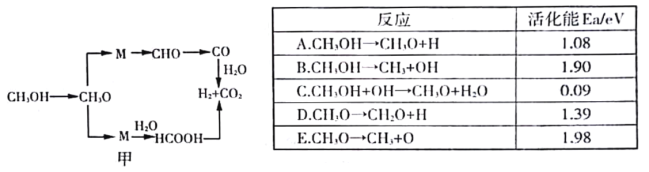
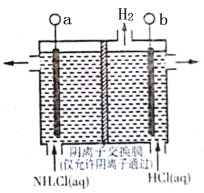
在传统的电解氯化氢回收氯气技术的基础上,科学家最近采用碳基电极材料设计了一种新的工艺方案,主要包括电化学过程和化学过程,如图所示,下列说法正确的是
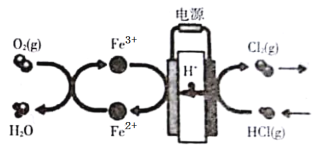
A.负极区发生的反应有Fe3++e-= Fe2+,4Fe2++O2+4H+=4Fe3++2H2O
B.Fe2+在过程中起催化剂作用
C.阳极材料可选用Ag
D.电路中转移1 mol电子时,消耗氧气5.6L
难度: 中等查看答案及解析
-
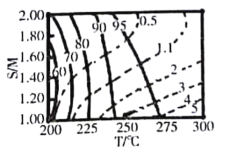
常温时,l mol·L-1的HClO2和1 mol·L-1的HMnO4两种溶液,起始时的体积均为V0,分别向两溶液中加水稀释至体积为V,所得曲线如图所示。下列说法正确的是
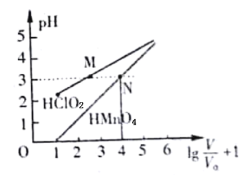
A.当稀释至pH均为3时,溶液中c(ClO2-)>c(MnO4-)
B.在0≤pH≤5时,HMnO4溶液满足:pH=
C.等pH的HClO2和HMnO4分别与足量Zn反应放出H2的体积HClO2>HMnO4
D.稀释前分别用l mol·L-1的NaOH溶液中和,消耗NaOH溶液的体积:HMnO4>HClO2
难度: 困难查看答案及解析


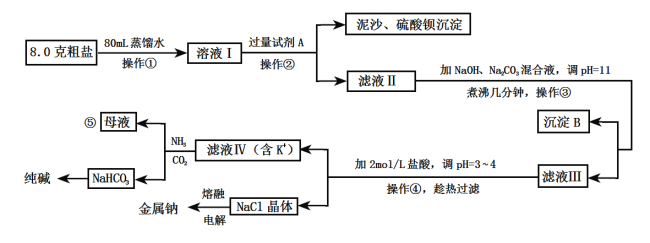
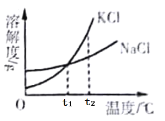
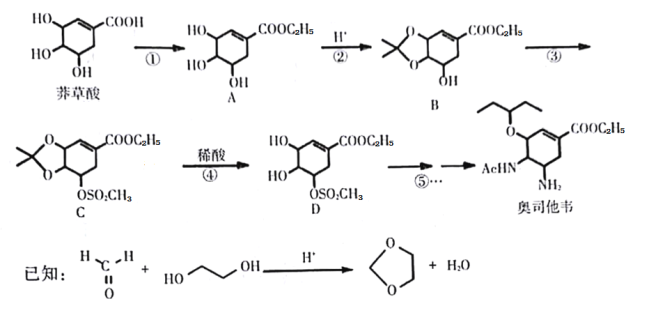
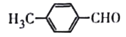
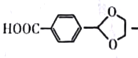
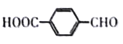
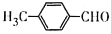 制备对醛基苯甲酸
制备对醛基苯甲酸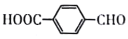 的合成路线如下图所示。
的合成路线如下图所示。