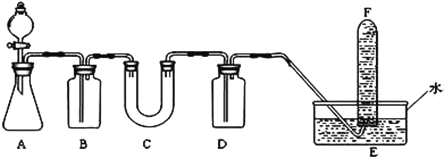
-
下列关于元素周期表应用的说法正确的是
A. 为元素性质的系统研究提供指导,为新元素的发现提供线索
B. 在金属与非金属的交界处,寻找可做催化剂的合金材料
C. 在IA、IIA族元素中,寻找制造农药的主要元素
D. 在过渡元素中,可以找到半导体材料
难度: 简单查看答案及解析
-
美国化学家鲍林教授具有独特的化学想象力:只要给他物质的分子式,他就能大体上想象出这种物质的分子结构模型.多核离子所带电荷可以认为是中心原子得失电子所致,根据VSEPR模型,下列离子中所有原子都在同一平面上的一组是( )
A. NO2﹣和NH4+ B. H3O+和ClO3﹣
C. NO3﹣和CO32﹣ D. PO43﹣和SO42
难度: 中等查看答案及解析
-
下列各组元素属于p区的是( )
A. 原子序数为1、2、7的元素 B. S、O、P C. Fe、Ar、Cl D. Na、Li、Mg
难度: 中等查看答案及解析
-
关于原子轨道的说法正确的是 ( )
A.凡是中心原子采取sp3杂化轨道成键的分子其空间构型都是正四面体型
B.CH4分子中的sp3杂化轨道是由4个H原子的1s轨道和C原子的2p轨道混合起来而形成的
C.sp3杂化轨道是由同一个原子中能量相近的s轨道和p轨道混合起来形成的一组能量相近的新轨道
D.凡AB3型的共价化合物,其中心原子A均采用sp3杂化轨道成键
难度: 中等查看答案及解析
-
下列说法中正确的是
A.P4、CS2、PH3都是非极性分子
B.金刚石和C60都是原子晶体
C.aXm﹣和bYn﹣是电子层结构相同的短周期元素的离子,若n>m,则原子半径X>Y
D.短周期元素的最高价氧化物对应的水化物的碱性:M(OH)m>N(OH)n,则离子氧化性:Mm+<Nn+
难度: 简单查看答案及解析
-
同一周期的X、Y、Z三种元素,已知最高价氧化物对应水化物的酸性强弱是H3XO4<H2YO4<HZO4,下列推断正确的是( )
A. 原子序数:X>Y>Z
B. 主族序数:Y>X>Z
C. 气态氢化物稳定性:XH3<H2Y<HZ
D. 元素的非金属性强弱:X>Y>Z
难度: 简单查看答案及解析
-
下列性质的递变规律不正确的是
A. HCl、HBr、HI 稳定性依次减弱
B. Na、Mg、Al 的原子半径依次增大
C. NaOH、KOH、CsOH 碱性依次增强
D. Li、Na、K、Rb、Cs单质的失电子能力依次增强
难度: 中等查看答案及解析
-
下列分子中键角最大的是( )
A.
B.
C.
D.
难度: 简单查看答案及解析
-
X、Y、Z为短周期元素,X的最外层电子数是Y原子最外层电子数的2倍,Y的原子序数比X的原子序数多5,Z原子的最外层电子数比Y多3。下列叙述正确的是( )
A.原子半径的大小顺序:Z>X>Y
B.Z单质与X单质直接反应可生成两种化合物
C.工业上,电解X和Y形成的化合物制取Y单质
D.Y、Z元素的最高价氧化物的水化物不能互相反应
难度: 简单查看答案及解析
-
NA为阿伏加德罗常数,下列说法正确的是
A. 124 g P4含有P—P键的个数为4NA B. 12 g石墨中含有C—C键的个数为1.5NA
C. 12 g金刚石中含有C—C键的个数为4NA D. 60gSiO2中含Si—O键的个数为2NA
难度: 中等查看答案及解析
-
前四周期元素A、B、C、D、E原子序数依次增大。已知:A、C同主族,A的原子最外层电子数是次外层的3倍,B的氧化物既能溶于强酸,又能溶于强碱,D的原子半径是第3周期中最小的,E是形成骨骼和牙齿的主要元素,且E单质能和水反应。则下列分析错误的是
A.A的离子结构示意图为

B.D的最高价氧化物的水化物的酸性大于C的最高价氧化物的水化物的酸性
C.E和D形成的离子化合物ED2的电子式为
D.B的氧化物为离子化合物,只含离子键,其晶体为离子晶体
难度: 中等查看答案及解析
-
下列各项叙述中,正确的是 ( )
A.N、P、As的电负性随原子序数的增大而增大
B.价电子排布为4s24p3的元素位于第四周期第ⅤA族,是p区元素
C.2p和3p轨道形状均为哑铃形,能量也相等
D.氮原子的最外层电子排布图:
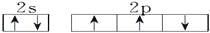
难度: 中等查看答案及解析
-
几种短周期元素的原子半径及主要化合价如下表:
元素代号
L
M
X
R
T
原子半径/nm
0.160
0.143
0.102
0.089
0.074
主要化合价
+2
+3
+6、-2
+2
-2
下列说法正确的是( )
A.离子半径大小:r(M3+)<r(T2-) B.其中R的金属性最强
C.煤和石油中不存在X元素 D.L、X形成的简单离子核外电子数相等
难度: 中等查看答案及解析
-
下列有关化学用语的表述正确的是( )
A.37Cl-的结构示意图:
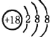 B.中子数为7的碳原子:
B.中子数为7的碳原子:C
C.NH3的结构式:
D.次氯酸的电子式:
难度: 简单查看答案及解析
-
对于下列化学用语,有关说法不正确的是( )
①CO2 ②Fe3+ ③KMnO4 ④
⑤
A. ①表示的是两种元素组成的化合物
B. ②中数字的含义:一个铁离子带3个单位的正电荷
C. ③中锰元素的化合价为+7价
D. ④⑤表示的是同一种元素
难度: 简单查看答案及解析
-
元素性质呈周期性变化的决定因素是( )
A. 元素原子半径呈周期性变化 B. 元素的相对原子质量依次递增
C. 元素原子核外电子排布呈周期性变化 D. 元素的最高正化合价呈周期性变化
难度: 简单查看答案及解析
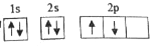 ,该同学所画的电子排布图违背了___________。
,该同学所画的电子排布图违背了___________。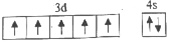 b.
b.
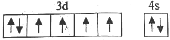 d.
d.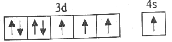
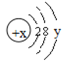 试回答:
试回答: