-
下列解释事实的离子方程式正确的是
A. 铜丝溶于浓硝酸生成绿色溶液:3Cu+8H++2NO3-==3Cu2++2NO↑+4H2O
B. 稀硫酸与Ba(OH)2溶液混合出现浑浊:H++OH-+ Ba2++SO42- =BaSO4↓+H2O
C. 澄清石灰水中加入过量小苏打溶液出现浑浊:Ca2++ 2HCO3-+2OH-= CaCO3↓+CO32-+ 2H2O
D. 在A1C13溶液中加入过量氨水出现浑浊:A13++3OH-= Al(OH)3↓
难度: 中等查看答案及解析
-
《本草衍义》中对精制砒霜过程有如下叙述:“取砒之法,将生砒就置火上,以器覆之,令砒烟上飞着覆器,遂凝结累然下垂如乳,尖长者为胜,平短者次之。”文中涉及的操作方法是
A.蒸馏 B.升华 C.干馏 D.萃取
难度: 简单查看答案及解析
-
“一带一路”贸易使国外的特色产品走入百姓的日常生活,下列商品的主要成分所对应的材料类型不正确的是( )
A
B
C
D

泰国银饰

埃及棉制品

捷克水晶饰品

土耳其彩瓷
金属材料
天然高分子材料
合成高分子材料
无机非金属材料
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
下列我国古代的技术应用中,不涉及氧化还原反应的是
A. 煅烧贝壳
 B. 粮食酿醋
B. 粮食酿醋
C. 古法炼铁
 D. 火药爆炸
D. 火药爆炸
难度: 简单查看答案及解析
-
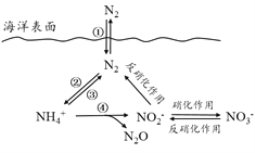
下列关于自然界中氮循环(如图)的说法不正确的是:
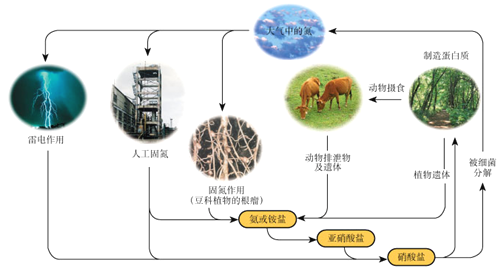
A.氮元素均被氧化
B.工业合成氨属于人工固氮
C.含氮无机物和含氮有机物可相互转化
D.碳、氢、氧三种元素也参与了氮循环
难度: 中等查看答案及解析
-
下列解释事实的方程式不正确的是
A. 用Na2S处理含Hg2+废水:Hg2+ + S2− = HgS↓
B. 燃煤中添加生石灰减少SO2的排放:2CaO + O2 + 2SO2
2CaSO4
C. 工业上将Cl2 通入石灰乳中制漂白粉:Cl2 + OH- = Cl-+ ClO- + H2O
D. 向漂白液中加入适量洁厕灵(含盐酸),产生氯气:ClO-+ Cl-+2H+ = Cl2↑+ H2O
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.pH=1的溶液中:
、
、K+、Cl-
B.遇酚酞变红的溶液中:
、Na+、
、K+
C.c(
)=1mol·L-1的溶液中:H+、Fe2+、Cl-、
D.无色透明溶液中:K+、
、Na+、
难度: 简单查看答案及解析
-
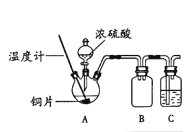
下列制取SO2、验证其漂白性、收集并进行尾气处理的装置和原理能达到实验目的的是( )
A.
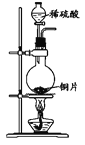 制取SO2 B.
制取SO2 B. 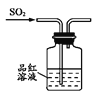 验证漂白性
验证漂白性C.
 收集SO2 D.
收集SO2 D. 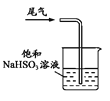 尾气处理
尾气处理难度: 中等查看答案及解析
-
在给定的条件下,下列物质的转化能实现的是
A.S
SO3
H2SO4
B.Na
Na2O
Na2CO3
C.NH3
NO2
HNO3
D.Al2O3
NaAlO2(aq)
Al(OH)3
难度: 中等查看答案及解析
-
下列说法不正确的是
A. 乙醇的沸点高于丙烷
B. 氨基酸既能与盐酸反应,也能与NaOH反应
C. 室温下在水中的溶解度:乙二醇>苯酚>溴乙烷
D. 光照时异戊烷发生取代反应生成的一氯代物最多有5种
难度: 中等查看答案及解析
-
扁桃酸衍生物是重要的医药中间体,下列关于这种衍生物的说法正确的是
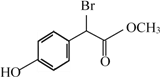
A. 分子式为C9H8O3Br
B. 不能与浓溴水反应生成沉淀
C. 与HCHO一定条件下可以发生缩聚反应
D. 1mol此衍生物最多与2mol NaOH发生反应
难度: 中等查看答案及解析
-
以氯酸钠(NaClO3)等为原料制备亚氯酸钠(NaClO2)的工艺流程如下,下列说法中,不正确的是

A. 反应1中,每生成1 mol ClO2有0.5 mol SO2被氧化
B. 从母液中可以提取Na2SO4
C. 反应2中,H2O2做氧化剂
D. 采用减压蒸发可能是为了防止NaClO2受热分解
难度: 困难查看答案及解析
-
下列实验操作及现象能够达成相应实验目的的是
实验目的
实验操作及现象
A
检验Na2SO3溶液是否变质
向Na2SO3溶液中加入Ba(NO3)2溶液,出现白色沉淀,再加入稀硝酸,沉淀不溶解
B
证明酸性条件下H2O2氧化性强于I2
向淀粉KI溶液中滴入3滴稀硫酸,未见溶液变蓝;再加入10%的H2O2溶液,溶液立即变蓝色
C
证明碳的非金属性强于硅
将浓盐酸滴入碳酸钠固体中,生成的气体通入盛有水玻璃的试管中,出现浑浊
D
证明SO2具有漂白性
将SO2通入酸性KMnO4 溶液中,溶液紫色褪去
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得氢气,具体流程如下:
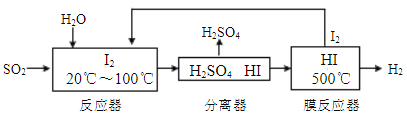
下列说法正确的是
A.分离器中的物质分离操作为过滤
B.膜反应器中,增大压强有利于提高速率和HI的平衡转化率
C.该工艺中I2和HI的相互转化体现了“碘循环”
D.碘循环工艺的总反应为2SO2+4H2O+ I2=H2+2H2SO4+2HI
难度: 中等查看答案及解析

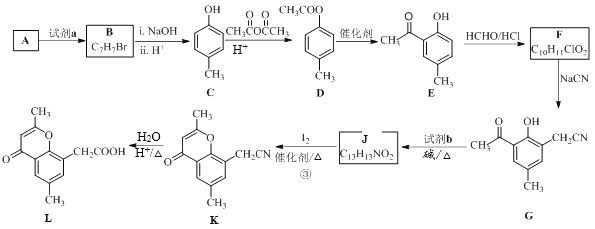 已知部分有机化合物转化的反应式如下:
已知部分有机化合物转化的反应式如下: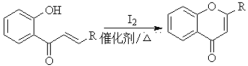 (R代表烃基或氢)
(R代表烃基或氢)