-
现有四种元素的基态原子的电子排布式如下:
①1s22s22p63s23p4 ②1s22s22p63s23p3 ③1s22s22p3 ④1s22s22p5
则下列有关比较中正确的是( )
A. 最高正化合价:④>③=②>① B. 原子半径:④>③>②>①
C. 电负性:④>③>②>① D. 第一电离能:④>③>②>①
难度: 中等查看答案及解析
-
前四周期元素中,基态原子中未成对电子数与其所在周期数相同的元素有
A.3种 B.4种 C.5种 D.6种
难度: 简单查看答案及解析
-
分子式为C5H10O2的酯共有(不考虑立体异构) :
A.7种 B.8种 C.9种 D.10种
难度: 中等查看答案及解析
-
面对突如其来的新冠病毒,越来越多的人意识到学习化学的重要性。下列说法正确的是
A.医用酒精灭活新冠肺炎病毒是利用其氧化性
B.N95口罩所使用的聚丙烯材料属于合成纤维
C.酒精浓度越高,灭新型冠状肺炎病毒效果越好
D.我国研制的重组新冠疫苗无需冷藏保存
难度: 简单查看答案及解析
-
二甲醚和乙醇是同分异构体,其鉴别可采用化学方法及物理方法,下列鉴别方法中不能对二者进行鉴别的是
A.利用金属钠或者金属钾 B.利用红外光谱法
C.利用质谱法 D.利用核磁共振氢谱
难度: 简单查看答案及解析
-
下列物质的沸点按由高到低顺序排列正确的是
①丙三醇 ② 丁烷 ③ 乙二醇 ④ 乙醇
A.①②③④ B.④③②① C.②①③④ D.①③④②
难度: 简单查看答案及解析
-
2020年,我省爆发了新型冠状病毒肺炎疫情,严重影响了人民的健康。茚地那韦或对新型肺炎有治疗效果。茚地那韦的结构简式如图所示。下列有关茚地那韦说法正确的是
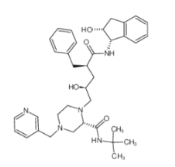
A.可以发生取代反应和消去反应
B.苯环上的一溴代物只有五种
C.分子中含氧官能团有羟基和羧基
D.该分子属于合成高分子化合物
难度: 中等查看答案及解析
-
下列叙述正确的是
A.NH3是极性分子,分子中N原子处在3个H原子所组成的三角形的中心
B.H2S是极性分子,分子中O原子处在2个H原子所连成的直线的中央
C.CCl4是非极性分子,分子中C原子处在4个Cl原子所组成的正方形的中心
D.CO2是非极性分子,分子中C原子处在2个O原子所连成的直线的中央
难度: 中等查看答案及解析
-
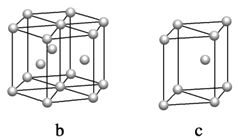
有四种不同堆积方式的金属晶体的晶胞如图所示,有关说法正确的是
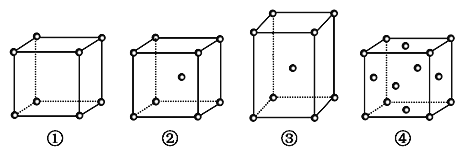
A.晶胞中原子的配位数分别为①6,②8,③8,④12
B.空间利用率的大小关系为①<②<③<④
C.①为简单立方堆积,②为镁型,③为钾型,④为铜型
D.每个晶胞含有的原子数分别为①1个,②2个,③2个,④4个
难度: 中等查看答案及解析
-
下列有关晶体的说法中正确的是
A.原子晶体中只存在非极性共价键
B.稀有气体形成的晶体属于原子晶体
C.在晶体中有阳离子的同时不一定有阴离子
D.非金属氧化物固态时都属于分子晶体
难度: 中等查看答案及解析
-
某物质的实验式为 PtCl4·2NH3,其水溶液不导电,加入AgNO3溶液反应也不产生沉淀,以强碱处理并没有NH3放出,则关于此化合物的说法中正确的是
A.配合物中中心原子的电荷数和配位数均为6
B.中心原子杂化类型为sp3杂化
C.1摩尔该分子中含有σ键数目为12
D.Cl-和NH3分子均与Pt4+配位
难度: 中等查看答案及解析
-
下列对分子的性质的解释中,不正确的是
A.CH≡C-CH=CH-CH3 中σ键和π键数目之比为 10:3
B.
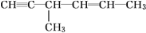 分子中不含手性碳原子
分子中不含手性碳原子C.硫难溶于水,微溶于酒精,易溶于 CS2,说明极性:水>酒精>CS2
D.由
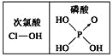 知酸性:H3PO4>HClO
知酸性:H3PO4>HClO难度: 中等查看答案及解析
-
下列关于晶体的说法正确的组合是 ( )
①分子晶体中都存在共价键
②在晶体中只要有阳离子就一定有阴离子
③金刚石、SiC、NaF、NaCl、H2O、H2S晶体的熔点依次降低
④离子晶体中只有离子键没有共价键,分子晶体中肯定没有离子键
⑤CaTiO3晶体中(晶胞结构如图所示)每个Ti4+和12个O2-相紧邻
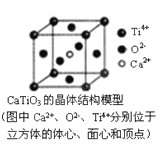
⑥SiO2晶体中每个硅原子与两个氧原子以共价键相结合
⑦晶体中分子间作用力越大,分子越稳定
⑧氯化钠熔化时离子键被破坏
A.①②③⑥ B.①②④ C.③⑤⑦ D.③⑤⑧
难度: 困难查看答案及解析
-
二茂铁[(C5H5)2Fe]分子是一种金属有机配合物,是燃料油的添加剂,用以提高燃烧的效率和去烟,可作为导弹和卫星的涂料等。它的结构如图所示,下列说法不正确的是
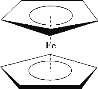
A.二茂铁属于分子晶体
B.环戊二烯中碳原子的杂化方式有sp3和sp2
C.1mol 环戊二烯(
)中含有σ键的数目为5NA
D.二茂铁分子中的化学键有极性共价键、非极性共价键和配位键
难度: 简单查看答案及解析
-
2019年8月科学家在Science杂志首次报道了具有半导体特性的18个原子纯碳环分子(如图所示)。下列说法不正确的是
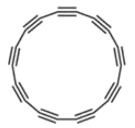
A.该分子所有的碳杂化方式都是sp
B.该分子可能要比苯更加活泼
C.该分子属于有机物
D.该分子具有半导体的功能,可以使类似的直碳链成为分子级电子元件
难度: 简单查看答案及解析
-
将石墨置于熔融的钾或气态钾中,石墨吸收钾形成名称为钾石墨的物质,其组成可以是C8K、C12K、C24K、C36K、C48K、C60K 等。下列分析正确的是
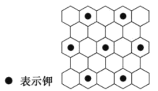
A.题干中所列举的 6 种钾石墨属于有机高分子化合物
B.钾石墨中碳原子的杂化方式是 sp3 杂化
C.若某钾石墨的原子分布如图所示,则它所表示的是 C12K
D.最近两个 K 原子之间距离为石墨中 C—C 键键长的2
倍
难度: 困难查看答案及解析
-
2020年1月11日科教频道,以短片介绍了周其林院士“万能”手性催化剂。手性一词来源于希腊语手,是自然界中广泛存在的一种现象。比如我们的左手照镜子时看到的模样与右手一模一样。但在现实世界中,我们的左手却永远无法与右手完全重合,这种现象就叫手性。具有手性特征的物体就叫手性物体。下列说法正确是
A.催化剂在催化过程中实际参与了反应,并改变反应的进程
B.“万能”手性催化剂可以催化任何一种反应
C.催化剂可以加快反应速率,提高反应物的转化率
D.氯仿、甲醇具有手性
难度: 简单查看答案及解析
-
间氯苯胺由
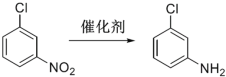 反应制备得到。间氯硝基苯的熔点44-46℃,沸点235-236℃。下列说法正确的是
反应制备得到。间氯硝基苯的熔点44-46℃,沸点235-236℃。下列说法正确的是A.间氯硝基苯与硝基苯互为同系物
B.间氯硝基苯,常温下呈液体,不溶于水,易溶于苯和甲苯
C.间氯硝基苯制备间氯苯胺,该过程发生了还原反应
D.理论上,在间氯硝基苯制备间氯苯胺过程中,每转移1mole-,需消耗锌粉65g
难度: 简单查看答案及解析
-
现在正是全球抗击新冠病毒的关键时期,专家指出磷酸氯喹对治疗新冠病毒感染有明显效果,磷酸氯喹的分子结构如图所示,下列关于该有机物的说法正确的是( )

A.该有机物的分子式为:C18H30N3O8P2Cl
B.该有机物能够发生加成反应、取代反应、不能发生氧化反应
C.该有机物苯环上的1-溴代物只有2种
D.1mol该有机物最多能和8molNaOH发生反应
难度: 中等查看答案及解析
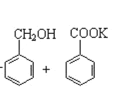 ;
;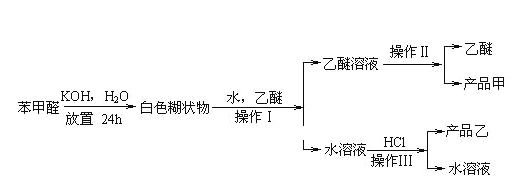
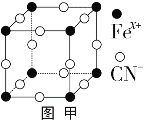
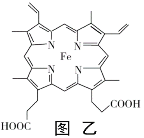

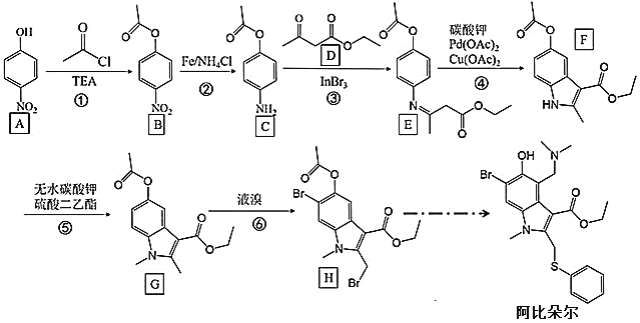
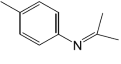 的合成路线。_____________
的合成路线。_____________