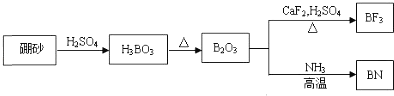
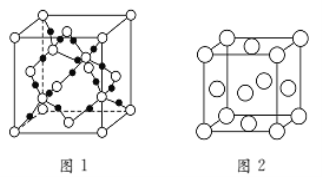
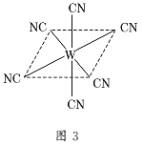
-
下列说法正确的是( )
A.前四周期中,原子最外层为1个电子的元素有5种
B.Fe2+的价电子排布为3d6
C.2p轨道上有1个未成对电子的原子与3p轨道上有1个未成对电子的原子化学性质相似
D.AB3型分子的中心原子A采取sp3杂化
难度: 中等查看答案及解析
-
水的状态除了气、液和固态外,还有玻璃态。它是由液态水急速冷却到165K(零下108℃)时形成的,玻璃态的水无固定形状,不存在晶体结构,且密度与普通液态水的密度相同,有关玻璃态水的叙述正确的是( )
A.水由液态变为玻璃态,体积缩小 B.水由液态变为玻璃态,体积膨胀
C.玻璃态是水的一种特殊状态 D.玻璃态水是分子晶体
难度: 中等查看答案及解析
-
从电负性的角度来判断下列元素之间易形成共价键的是( )
A.Na和Cl B.H和Cl C.K和F D.Ca和O
难度: 中等查看答案及解析
-
海底有大量的天然气水合物,可满足人类1000年的能源需要。天然气水合物是一种晶体,晶体中平均每46个水分子构建成8个笼,每个笼可容纳1个CH4分子或1个游离H2O分子。若晶体中每8个笼只有6个容纳了CH4分子,另外2个笼被游离H2O分子填充,则天然气水合物的平均组成可表示为
A.CH4·14H2O
B.CH4·8H2O
C.CH4·
H2O
D.CH4·6H2O
难度: 中等查看答案及解析
-
下列过程中,共价键被破坏的是
A.SiO2晶体熔化 B.酒精溶于水 C.冰融化成水 D.碘升华
难度: 中等查看答案及解析
-
下列说法中正确的是
A.s区都是金属元素 B.s区都是主族元素
C.稀有气体在ds区 D.所有非金属元素都在p区
难度: 中等查看答案及解析
-
关于离子键、共价键的各种叙述中,下列说法中正确的是
A.在离子化合物里不可能存在共价键
B.非极性键只存在于单质分子中
C.在共价化合物里不可能存在离子键
D.由不同元素组成的多原子分子里,一定只存在极性键
难度: 中等查看答案及解析
-
下列式子中,能真实表示物质分子组成的是
A.Al B.C C.SiO2 D.CO2
难度: 中等查看答案及解析
-
X、Y、Z、W是短周期中构成蛋白质的重要元素,其性质见表,元素简单气态氢化物的沸点最高的是
X
Y
Z
W
化合价
-4
-2
-3
-2
电负性
2.5
2.5
3.0
3.5
A.X B.Y C.Z D.W
难度: 中等查看答案及解析
-
下列说法不正确的是
A.某粒子空间构型为平面三角形,则中心原子一定是sp2杂化
B.某粒子空间构型为V形,则中心原子一定有孤电子对
C.某粒子空间构型为三角锥形,则该粒子一定是极性分子
D.某粒子空间构型为正四面体,则键角一定是109°28′
难度: 简单查看答案及解析
-
下列各组原子中,彼此化学性质一定相似的是 ( )
A.原子核外电子排布式为l s2的X原子与原子核外电子排布式为ls22s2的Y原子
B.原子核外M层上仅有两个电子的X原子与原子核外N层上仅有两个电子的Y原子
C.2p轨道上有一个空轨道的X原子与3p轨道上有一个空轨道的Y原子
D.最外层都只有一个电子的X、Y原子
难度: 中等查看答案及解析
-
下列叙述中,正确的是( )
A.在一个基态多电子的原子中,可以有两个运动状态完全相同的电子
B.在一个基态多电子的原子中,不可能有两个能量完全相同的电子
C.如果某一基态原子3p轨道上仅有2个电子,它们自旋方向必然相反
D.在一个基态多电子的原子中,M层上的电子能量肯定比L层上的电子能量高
难度: 中等查看答案及解析
-
下列说法不正确的是
A.1 mol 冰中拥有2 mol氢键
B.分子晶体中既有范德华力,又有共价键
C.干冰晶体中,每个CO2分子周围最近且距离相等的CO2分子共有12个
D.晶体熔点:晶体硅<SiC
难度: 困难查看答案及解析
-
下列关于粒子结构的描述正确的是
A.NF3和BF3是中心原子杂化类型相同的极性分子
B.CH2Cl2和C2H4是空间构型不同的非极性分子
C.在SiO2晶体中,Si原子与Si—O键数目比为1︰2
D.CF4和CO2是含极性键的非极性分子
难度: 中等查看答案及解析
-
下列粒子(或化学键)的数目之比不是1∶1的是
A.氘原子中的质子和中子
B.Na2O2固体中的阴离子和阳离子
C.CO2分子中的σ键和π键
D.NaHCO3晶体中的阳离子和阴离子
难度: 中等查看答案及解析
-
现有四种元素的基态原子的电子排布式如下:① 1s22s22p63s23p4; ②1s22s22p63s23p3; ③1s22s22p3; ④1s22s22p5。则下列有关比较中正确的是
A.第一电离能:①>② B.原子半径:④>③
C.电负性: ②>③ D.氢化物稳定性:①>②
难度: 中等查看答案及解析