-
已知A、B、C、D、M、W六种元素的原子序数依次递增,都位于前四周期。其中A、D原子的最外层电子数均等于其周期序数,且D原子的电子层数是A的3倍;B原子s轨道电子数是p轨道电子数的两倍;C原子L层上有2对成对电子。M和W均有“生物金属”之称,M4+和氩原子的核外电子排布相同;W处于元素周期表中第8列。请回答下列问题:
⑴1 mol B2A2分子中含σ键的数目是________。
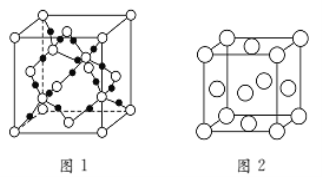
⑵BC2在高温高压下所形成的晶体其晶胞如图1所示。则该晶体的类型属于________晶体(填“分子”、“原子”);该晶体中B原子轨道的杂化类型为________。
⑶“生物金属”M的晶胞如图2所示。则晶胞中一个M原子与_____个M原子紧邻;若该晶体的密度为ρ g·cm-3,阿伏加德罗常数为NAmol-1,M原子的摩尔质量为Mrg·mol-1,则该晶胞的“边长”为________cm。
⑷“生物金属”W元素应用广泛,如人体内W元素的含量偏低,则会影响O2在体内的正常运输。已知W2+与KCN溶液反应得W(CN)2沉淀,当加入过量KCN溶液时沉淀溶解,生成配合物,其配离子结构如图3所示。
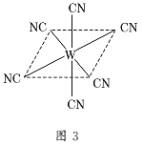
①W元素基态原子价电子排布式为________。
②1个CN-中π键数目为________。
⑸光谱证实单质D与强碱溶液反应有[D(OH)4]-生成,则[D(OH)4]-中存在________(填字母)。
a 共价键 b 配位键 c σ键 d π键
-
A、B、C、D、E都是元素周期表中的前20号元素,它们的原子序数依次递增。已知B、D两种元素原子的最外层电子数是最内层电子数的两倍,而C元素原子的最外层电子数等于B元素原子的核外电子数,E的价电子数为1.回答下列问题。
(1)画出C元素的原子结构示意图 。
(2)在1mol DC2中,有 mol D—C键。
(3)在化合物BC2的晶体中,每个BC2分子周围与它距离最近的BC2分子有 个。
(4)原子序数介于B、C之间的元素X和B、C都可与A形成10e-的化合物。则X、B、C的第一电离能顺序是 (填元素符号),三种10e-的化合物中沸点最低的 。
(5)已知高温下C和E元素形成的晶体呈立方体结构,晶体中元素C的化合价部分为0价,部分为-2价。如下图所示为C和E元素形成的晶体的一个晶胞(晶体中最小的重复单元),则下列说法中正确的是 。

A.该晶体化学式为EC2(KO2),每个晶胞含有个4个E+和4个C2-
B.晶体中每个E+周围有8个C2-,每个C2-周围有8个E+
C.晶体中与每个E+距离最近的E+有8个
D.晶体中,0价C与-2价C的数目比为3:1
E.C2-与N2互为等电子体
-
短周期元素R、X、Y、Z的原子序数依次递增,R的无氧酸溶液能在玻璃容器上刻标记;R和X能形成XR3型化合物,X在化合物中只显一种化合价;R和Z位于同主族,Y原子最外层电子数等于电子层数的2倍。下列有关推断正确的是
A. R单质和Z单质均可与水发生反应置换出O2
B. 上述元素形成的简单离子都能促进水的电离平衡
C. YR6能在氧气中剧烈燃烧
D. 元素对应的简单离子的半径: Y>Z>R>X
-
短周期元素R、X、Y、Z的原子序数依次递增,R的无氧酸溶液能在玻璃容器上刻标记;R和X能形成XR3型化合物,X在化合物中只显一种化合价;R和Z位于同主族,Y原子最外层电子数等于电子层数的2倍。下列有关推断正确的是
A. R单质和Z单质均可与水发生反应置换出O2
B. 上述元素形成的简单离子都能促进水的电离平衡
C. YR6能在氧气中剧烈燃烧
D. 元素对应的简单离子的半径: Y>Z>R>X
-
短周期元素A、B、C、D的原子序数依次递增,它们的原子序数之和为34,且原子最外层电子数之和为10;A、C原子的最外层电子数之和等于B原子的次外层电子数;A与C,B与D均为同主族元素。下列叙述正确的是
A. B、D的最高价氧化物都不能和酸反应
B.最高价氧化物对应的水化物的碱性:A>C
C.A的原子半径为这四种当中最小的
D.四种元素中B形成化合物的种类最多
-
短周期元素X、Y、Z、W的原子序数依次递增,它们的原子序数之和为32,且原子最外层电子数之和为10,X、Z原子的最外层电子数之和等于Y原子的次外层电子数,X与Z,Y与W均为同主族元素。下列叙述正确的是
A. Z、W单质的熔点:Z>W
B. 最高价氧化物对应的水化物的酸性:Y>W
C. 四种元素的原子半径:X>Y>Z>W
D. Z元素处于元素周期表中第三周期第ⅡA族
-
短周期元素A、B、C的原子序数依次递增,三者原子最外层电子数之和为14,A原子的次外层电子数等于B原子的最外层电子数,A与C同主族。则下列叙述正确的是
A.原子半径:A<B<C
B.氢化物稳定性:A<C
C.B与A的化合物比B与C的化合物熔点低
D.A与C的化合物属于大气污染物
-
短周期元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为13。X与Y、Z位于相邻周期,Z原子最外层电子数是X原子内层电子数的3倍或者是Y原子最外层电子数的3倍。下列说法正确的是( )
A. X的氢化物溶于水显酸性 B. Y原子的电子排布式为1s22s22p63s2
C. Z元素在周期表中的位置为第三周期第Ⅵ族 D. X和Z的最高价氧化物对应水化物都是弱酸
-
短周期元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为13.X与Y、Z位于相邻周期,Z原子最外层电子数是X原子内层电子数的3倍或者Y原子最外层电子数的3倍.下列说法正确的是( )
A.X的氢化物溶于水显酸性
B.Y的氧化物是离子化合物
C.Z的氢化物的水溶液在空气中存放不易变质
D.X和Z的最高价氧化物对应的水化物都是弱酸
-
短周期元素A、B、C的原子序数依次递增,它们的原子最外层电子数之和为10,A与C同主族,B原子的最外层电子数等于A原子的次外层电子数,则下列叙述正确的是
A.原子半径:A<B<C
B.三种元素的最高价氧化物对应水化物均可由化合反应得到
C.A的氢化物稳定性大于C的氢化物稳定性
D.B 和A的最高价氧化物可发生置换反应


