-
《天工开物》记载:“凡埏泥造瓦,掘地二尺余,择取无砂粘土而为之”,“凡坯既成,干燥之后,则堆积窖中燃薪举火”,“浇水转釉(主要为青色),与造砖同法”。下列说法错误的是
A. 粘土是制作砖瓦和陶瓷的主要原料
B. “燃薪举火”使粘土发生复杂的物理化学变化
C. 沙子和粘土的主要成分均为硅酸盐
D. 烧制后自然冷却成红瓦,浇水冷却成青瓦
难度: 中等查看答案及解析
-
下列变化的实质相似的是( )
①浓硫酸能在白纸上写字,氢氟酸能在玻璃上刻字 ②二氧化硫和氯气均能使品红溶液褪色
③二氧化硫能使高锰酸钾溶液、溴水褪色 ④氨气和硫化氢气体均不能用浓硫酸干燥
⑤常温下浓硫酸可用铁容器存放、加热条件下浓硫酸能与木炭反应
⑥浓硫酸和浓盐酸在空气中敞口放置时浓度均减小
A. 只有③⑤ B. 只有②③④ C. 只有③④⑥ D. 全部
难度: 中等查看答案及解析
-
下列各组物质中,分子中的所有原子都满足最外层8电子结构的是
①BeCl2、PF5 ②PCl3、N2 ③COCl2(光气)、SF6 ④XeF2、BF3 ⑤SO2、HClO
A. ①② B. ③④ C. ② D. ⑤
难度: 中等查看答案及解析
-
对溶液中的离子进行鉴定,下列实验所得结论不合理的是( )
A.溶液中加入稀硝酸后,再加入AgNO3溶液,有白色溶液生成,则溶液中可能含有Cl-
B.溶液中加入KSCN溶液,无红色出现,继续加入氯水,溶液变红色,说明溶液中事实上含有Fe2+
C.溶液中加入NaOH溶液,加热后产生使湿润的红色石蕊试纸变蓝的气体,则可能推测该溶液中含有NH4+
D.向溶液中加入盐酸,有使澄清石灰水变浑浊的无色无味的气体放出,可推测溶液中含有CO32-
难度: 中等查看答案及解析
-
下列各组物质的晶体中,所含化学键类型全部相同,熔化时所克服的作用力也完全相同是
A.CO2和SiO2
B.NaCl和HCl
C.(NH4)2CO3和CO(NH2)2(尿素)
D.NaH和KCl
难度: 简单查看答案及解析
-
下列化合物中阴离子半径和阳离子半径之比最大的是( )
A. LiI B. NaBr C. KCl D. CsF
难度: 中等查看答案及解析
-
有a、b、c、d四种金属,用导线两两相连插入稀硫酸中可以组成原电池,a、b相连时,a为负极;c、d相连时,电流由d到c;a、c相连时,a极发生氧化反应;b、d相连时,b极有大量气泡生成。则四种金属的活动性按由强到弱顺序排列的是
A.a>b>c>d B.a>c>d>b
C.c>a>b>d D.b>d>c>a
难度: 简单查看答案及解析
-
化学与环境、生产、生活关系密切,下列说法正确的是
A.84消毒液和医用酒精都可以起到杀菌消毒的作用,其作用原理相同
B.防控新冠病毒所用的酒精,其浓度越大,杀毒效果越好。
C.工业上常用高纯硅制造光导纤维
D.推广使用可降解塑料及布质购物袋,以减少“白色污染”
难度: 中等查看答案及解析
-
下列反应既属于氧化还原反应,又是放热反应的是( )
A.铝与盐酸反应 B.NaOH和HCl反应
C.Ba(OH)2·8H2O与NH4Cl的反应 D.CaCO3受热分解为CaO和CO2
难度: 简单查看答案及解析
-
下列各组化合物中,化学键的类型完全相同的是( )
①CaCl2 和Na2S ②CO2 和CS2 ③Na2O 和Na2O2 ④HCl 和NaOH
A.①② B.①③ C.②③ D.②④
难度: 中等查看答案及解析
-
如图所示,把锌片和铜片用导线相连后插入稀硫酸溶液中构成原电池。下列叙述正确的是( )
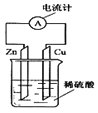
A.该装置将电能转变为化学能 B.电流从锌片经导线流向铜片
C.一段时间后,铜片质量减轻 D.锌片上发生氧化反应
难度: 简单查看答案及解析
-
下列表达方式错误的是( )
A.CO2分子的结构式:O=C=O
B.S2-的结构示意图:
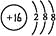
C.O—18的原子符号:
O
D.氯化氢分子的电子式:
难度: 简单查看答案及解析
-
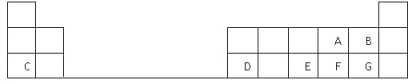
如图为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )
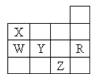
A.常压下五种元素的单质中Z单质的沸点最高
B.Y、Z的阴离子电子层结构都与R原子的相同
C.W的氢化物的稳定性比X的氢化物的稳定性强
D.Y元素的非金属性比W元素的非金属性强
难度: 简单查看答案及解析
-
新制氯水中含有多种成分,因而具有多种性质,下图所示新制氯水分别与四种物质发生反应,其中能证明新制氯水具有酸性的是
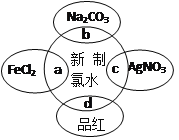
A.a B.b C.c D.d
难度: 简单查看答案及解析
-
无色的混合气体甲,可能含有NO、CO2、NO2、NH3、N2中的某几种。将100mL甲气体经过如图的实验处理,结果得到酸性溶液,而几乎无气体剩余。则甲气体的组成为( )

A.NH3、NO2、N2 B.NH3、NO2、CO2
C.NH3、NO、CO2 D.NO、CO2、N2
难度: 中等查看答案及解析
-
有M、A 、B、D、N、E六种短周期元素原子序数依次增大,M元素的单质是自然界最轻的气体,N元素的原子半径是所在周期中最大的,A、B、D、E四种元素在周期表中的相应位置如下图,它们的原子序数之和为37。下列说法不正确的是
A.沸点:M2D > BM3 > AM4
B.原子半径:rE>rA>rB >rD
C.化合物AnM2n分子中既含有极性鍵又含有非极性鍵
D.B元素的氢化物与D元素的单质在一定条件下能发生置换反应,且氧化剂与还原剂的物质的量之比为4∶3
难度: 中等查看答案及解析
-
短周期主族元素X、Y、W、Z的原子序数依次增大。其中X、Z同主族,Z的单质是一种良好的半导体材料,W3+与Y2—具有相同的核外电子数。下列叙述正确的是
A.Y2—的离子半径大于W3+的离子半径
B.Y、Z形成的化合物为离子化合物
C.Z的最高价氧化物对应的水化物的酸性比X的强
D.X的气态简单氢化物的稳定性比Y的强
难度: 中等查看答案及解析
-
我国安徽发现了全国最大的钼矿,下图所示是钼元素的相关信息,下列有关钼的说法错误的是
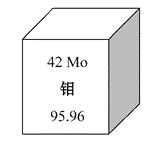
A.95Mo原子核内有53个中子
B.95Mo原子核外有42个电子
C.92Mo、95Mo、98Mo互为同位素
D.92Mo、95Mo、98Mo的化学性质有较大的不同
难度: 中等查看答案及解析
-
下表中a、b、c表示相应仪器中加入的试剂,可用如图装置制取、净化、收集的气体是( )
编号
气体
a
b
c
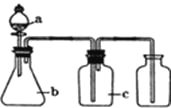
A
NH3
浓氨水
碱石灰
碱石灰
B
CO2
盐酸
碳酸钙
饱和NaHCO3溶液
C
NO
稀硝酸
铜屑
H2O
D
Cl2
浓盐酸
二氧化锰
饱和NaCl溶液
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
石墨在一定条件下转化为金刚石,其能量变化如图所示,其中ΔE1=393.5 kJ,ΔE2=395.4 kJ,下列说法正确的是
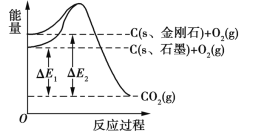
A. 1 mol石墨完全转化为金刚石需吸收1.9 kJ的能量
B. 石墨转化为金刚石属于物理变化
C. 金刚石的稳定性强于石墨的
D. 1 mol金刚石的能量大于1 mol CO2的能量
难度: 中等查看答案及解析
-
利用如图所示装置进行实验,下列说法正确的是
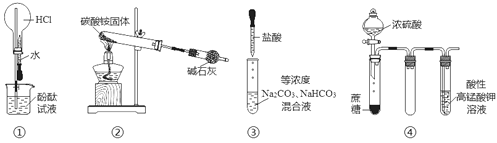
A.实验①可观察到红色喷泉
B.实验②可收集到少量氨气
C.实验③中逐滴滴加稀盐酸时,试管中立即产生大量气泡
D.实验④中酸性KMnO4溶液中有大量气泡出现,但溶液颜色不变
难度: 中等查看答案及解析
-
具有漂白作用的物质有:①84 消毒液 ②二氧化硫 ③过氧化氢 ④漂白粉,其漂白原理相同的是
A.①③ B.②③ C.①③④ D.①②④
难度: 中等查看答案及解析
-
根据下表中有关短周期元素性质的数据,下列说法不正确的是( )
①
②
③
④
⑤
⑥
⑦
⑧
原子半径(10-10m)
0.74
1.60
1.52
1.10
0.99
1.86
0.75
1.43
主要化合价
最高价
+2
+1
+5
+7
+1
+5
+3
最低价
-2
-3
-1
-3
A.元素④处于第三周期第VA族
B.元素③和⑥、元素④和⑦分别处于同一主族
C.元素①与元素⑥形成的化合物中不可能存在共价键
D.元素⑧对应的氢氧化物可能具有两性
难度: 中等查看答案及解析
-
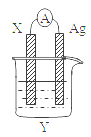
热激活电池可用作火箭、导弹的工作电源。一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能。该电池总反应为:PbSO4+2LiCl+Ca = CaCl2+Li2SO4+Pb。下列有关说法正确的是
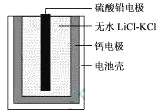
A.正极反应式:Ca + 2Cl--2e- = CaCl2
B.放电过程中,Li+向负极移动
C.每转移0.1mol电子,理论上生成20.7 g Pb
D.常温时,在正负极间接上电流表或检流计,指针不偏转
难度: 困难查看答案及解析