-
中国四大发明之一造纸术中蕴含着许多化学知识。下列有关说法错误的是
A.“纸上得来终觉浅”中“纸”的主要成分是纤维素
B.古代造纸工艺中常利用石灰的碱性来分离植物中含酸性官能团的木质素
C.现代造纸工艺中用二氧化硫漂白纸张的过程属于物理变化
D.废旧纸张的回收利用有利于环境保护和资源再利用
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值。下列说法正确的是
A.1.8 g NH4+含有的电子数为NA
B.1 L 1 mol·L-1的NaAlO2水溶液中含有的氧原子数为2NA
C.标况下,22.4 L NO与11.2 L O2充分反应后,生成物的分子总数为NA
D.50 mL 18 mol·L-1的浓硫酸与足量的铜片共热,生成SO2的分子数为0.45NA
难度: 简单查看答案及解析
-
原子序数依次增大的元素X、Y、Z、W,它们的最外层电子数分别为1、6、7、1。X-的电子层结构与氦相同,Y和Z的次外层有8个电子,Z-和W+的电子层结构相同。下列叙述错误的是
A.元素的非金属性顺序为X<Y<Z
B.X和其它3种元素均能形成共价化合物
C.W和其它3种元素均能形成离子化合物
D.元素X、Y、Z各自最高和最低化合价的代数和分别为0、4、6
难度: 简单查看答案及解析
-
下列实验方案、现象及结论均正确的是
选项
实验方案、现象
结论
A
用玻璃棒蘸取某样 品进行焰色反应,观察到黄色火焰
该样品中一定含钠元素
B
将石蜡油(液态石蜡)分解的产物通人溴的四氯化碳溶液中,溶液逐渐褪色
分解产物中一定含有乙烯
C
向酸性KMnO4溶液中先通人少量SO2,充分反应后,再滴入几滴BaCl2溶液,产生白色沉
SO2被氧化为SO42-
D
向FeCl, 溶液中加入过最的KI溶波,充分反应后,再滴入几滴KSCN溶液,溶液颜色变红
KI与FeCl3的反应为可逆反应
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
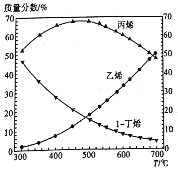
结构简式为
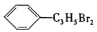 的有机物共有 种(不考虑立体异构)。
的有机物共有 种(不考虑立体异构)。A.7 B.8 C.9 D.10
难度: 困难查看答案及解析
-
碳酸二甲酯[(CH3O)2CO]是一种具有发展前景的“绿色”化工产品。电化学法合成碳酸二甲酯的工作原理如图所示。下列说法错误的是
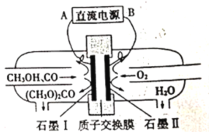
A.石墨I与直流电源正极相连
B.H+由石墨II通过质子交换膜向石墨I移动
C.石墨I上发生的电极反应为2CH3OH+CO-2e-=(CH3O)2CO+2H+
D.电解过程中,阴极和阳极消耗气体的物质的量之比为1:2
难度: 困难查看答案及解析
-
某酸在水溶液中,四种微粒的物质的量分数(δ)随溶液pH的变化曲线如图所示。下列说法正确的是

A.H3XO4为三元弱酸,NaH2XO4溶液呈碱性
B.-lgKa3=12.32
C.向0.1 mol/L的Na3XO4溶液中滴加几滴浓KOH溶液,
的值变大
D.0.1 mol/L的Na2HXO4溶液中,c(Na+)+c(H+)=c(XO43-)+c(HXO42-)+c(H2XO4-)+c(OH-)
难度: 困难查看答案及解析
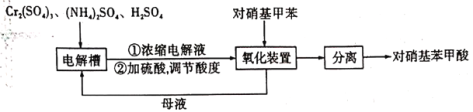
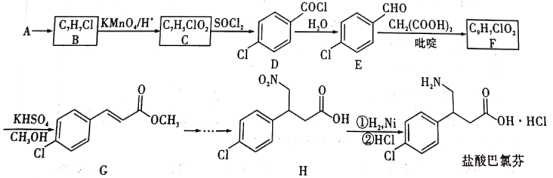
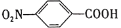 )是一种广泛用于医药、染料、感光材料等的重要精细化工中间体。工业上以对硝基甲苯(
)是一种广泛用于医药、染料、感光材料等的重要精细化工中间体。工业上以对硝基甲苯(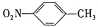 )、Cr(SO)3等物质为主要原料,通过间接电合成法制备对硝基苯甲酸,生产工艺流程如下:
)、Cr(SO)3等物质为主要原料,通过间接电合成法制备对硝基苯甲酸,生产工艺流程如下: