-
对硝基苯甲酸(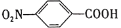 )是一种广泛用于医药、染料、感光材料等的重要精细化工中间体。工业上以对硝基甲苯(
)是一种广泛用于医药、染料、感光材料等的重要精细化工中间体。工业上以对硝基甲苯(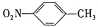 )、Cr(SO)3等物质为主要原料,通过间接电合成法制备对硝基苯甲酸,生产工艺流程如下:
)、Cr(SO)3等物质为主要原料,通过间接电合成法制备对硝基苯甲酸,生产工艺流程如下:
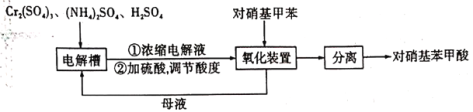
已知:①对硝基甲苯:黄色晶体,熔点为51.7℃,沸点为238.5℃,不溶于水,易溶于乙醇、乙醚、氯仿和苯。②对硝基苯甲酸:黄色晶体,熔点为242℃,沸点为359℃,微溶于水,溶于乙醇,能升华。
回答下列问题:
(1)电解制备Cr2O72-:用H型隔膜电解槽电解制备Cr2O72-,装置如下图1所示。外接电源的负极为__(填“A”或“B”),反应II的离子方程式为_______。
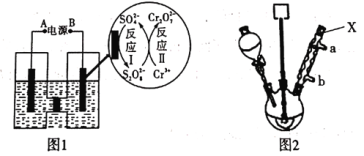
(2)氧化制备对硝基苯甲酸:用上图2所示装置制备对硝基苯甲酸,具体过程如下:
步骤1:向250 mL三颈烧瓶中依次加入一定量含Cr2O72-的电解液、对硝基甲苯,搅拌、水浴升温到设定温度,恒温下进行反应,直至反应液由棕红色变为墨绿色时为止。
步骤2:待反应混合物冷却至室温后,与适量冰水充分混合,抽滤。滤液返回电解槽中重新电解。
步骤3:把步骤2中抽滤所得固体溶于5%的热NaOH溶液中(约60℃),待温度降到50℃时,抽滤,向滤液中加入过量2 mol/L H2SO4,析出黄色沉淀,再抽滤,并用冷水洗涤,然后在低于80℃的条件下烘干,可得粗产品。
①仪器X的名称是_____,冷却水应从___口进入(填“a”或“b”)。
②步骤2中,抽滤所得固体的主要成分是_____。
③步骤3中,用NaOH溶液处理后,需待温度降到50℃时进行抽滤的原因是______。
④制得的粗产品需要进一步纯化,根据对硝基苯甲酸的有关性质可知,对其进行纯化还可以采用_____法完成。
⑤该合成技术的优点是实现了____(填化学式)的循环利用,绿色环保。
(3)测定对硝基苯甲酸的纯度:称取1.670 g粗产品,配成100 mL溶液,取25.00 mL溶液,用0.1000 mol·L-1 KOH溶液滴定,重复滴定四次,每次消耗KOH溶液的体积如下表所示。已知:对硝基苯甲酸的摩尔质量为167.0 g·mol-1,则对硝基苯甲酸的纯度为_____。
| 第一次 | 第二次 | 第三次 | 第四次 |
| 体积( mL) | 23.00 | 23.10 | 21.40 | 22.90 |
-
对硝基甲苯是医药、染料等工业的一种重要有机中间体,它常以浓硝酸为硝化剂,浓硫酸为催化剂,通过甲苯的硝化反应制备.
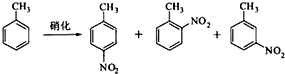
一种新的制备对硝基甲苯的实验方法是:以发烟硝酸为硝化剂,固体NaHSO4为催化剂(可循环使用),在CCl4溶液中,加入乙酸酐(有脱水作用),45℃反应1h.反应结束后,过滤,滤液分别用5% NaHCO3,溶液、水洗至中性,再经分离提纯得到对硝基甲苯.
(l)上述实验中过滤的目的是______.
(2)滤液在分液漏斗中洗涤静置后,有机层处于______层(填“上”或'下”);放液时,若发现液体流不下来,其可能原因除分液漏斗活塞堵塞外,还有______.
(3)下列给出了催化剂种类及用量对甲苯硝化反应影响的实验结果.
| 催化剂 | n(催化剂) | 硝化产物中各种异构体质量分数(%) | 总产率(%) |
| n(甲苯) | 对硝基甲苯 | 邻硝基甲苯 | 间硝基甲苯 |
| 浓H2SO4 | 1.0 | 35.6 | 60.2 | 4.2 | 98.0 |
| 1.2 | 36.5 | 59.5 | 4.0 | 99.8 |
| NaHSO4 | 0.15 | 44.6 | 55.1 | 0.3 | 98.9 |
| 0.25 | 46.3 | 52.8 | 0.9 | 99.9 |
| 0.32 | 47.9 | 51.8 | 0.3 | 99.9 |
| 0.36 | 45.2 | 54.2 | 0.6 | 99.9 |
①NaHSO4催化制备对硝基甲苯时,催化剂与甲苯的最佳物质的量之比为______.
②由甲苯硝化得到的各种产物的含量可知,甲苯硝化反应的特点是______.
③与浓硫酸催化甲苯硝化相比,NaHSO4催化甲苯硝化的优点有______、______.
-
对硝基甲苯是医药、染料等工业的一种重要有机中间体,它常以浓硝酸为硝化剂,浓硫酸为催化剂,通过甲苯的硝化反应制备.
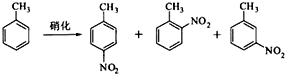
一种新的制备对硝基甲苯的实验方法是:以发烟硝酸为硝化剂,固体NaHSO4为催化剂(可循环使用),在CCl4溶液中,加入乙酸酐(有脱水作用),45℃反应1h.反应结束后,过滤,滤液分别用5% NaHCO3,溶液、水洗至中性,再经分离提纯得到对硝基甲苯.
(l)上述实验中过滤的目的是______.
(2)滤液在分液漏斗中洗涤静置后,有机层处于______层(填“上”或'下”);放液时,若发现液体流不下来,其可能原因除分液漏斗活塞堵塞外,还有______.
(3)下列给出了催化剂种类及用量对甲苯硝化反应影响的实验结果.
| 催化剂 | n(催化剂) | 硝化产物中各种异构体质量分数(%) | 总产率(%) |
| n(甲苯) | 对硝基甲苯 | 邻硝基甲苯 | 间硝基甲苯 |
| 浓H2SO4 | 1.0 | 35.6 | 60.2 | 4.2 | 98.0 |
| 1.2 | 36.5 | 59.5 | 4.0 | 99.8 |
| NaHSO4 | 0.15 | 44.6 | 55.1 | 0.3 | 98.9 |
| 0.25 | 46.3 | 52.8 | 0.9 | 99.9 |
| 0.32 | 47.9 | 51.8 | 0.3 | 99.9 |
| 0.36 | 45.2 | 54.2 | 0.6 | 99.9 |
①NaHSO4催化制备对硝基甲苯时,催化剂与甲苯的最佳物质的量之比为______.
②由甲苯硝化得到的各种产物的含量可知,甲苯硝化反应的特点是______.
③与浓硫酸催化甲苯硝化相比,NaHSO4催化甲苯硝化的优点有______、______.
-
对硝基甲苯是医药、染料等工业的一种重要有机中间体,它常以浓硝酸为硝化剂、浓硫酸为催化剂,通过甲苯的硝化反应制备。
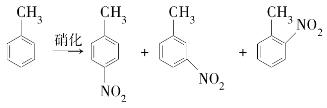
一种新的制备对硝基甲苯的实验方法是:以发烟硝酸为硝化剂,固体NaHSO4为催化剂(可循环使用),在CCl4溶液中,加入乙酸酐(有脱水作用),45 ℃反应1 h。反应结束后,过滤,滤液分别用5% NaHCO3溶液、水洗至中性,再经分离提纯得到对硝基甲苯。
(1)上述实验中过滤的目的是_____________________________________。
(2)滤液在分液漏斗中洗涤静置后,有机层处于________层(填“上”或“下”);放液时,若发现液体流不下来,其可能原因除分液漏斗活塞堵塞外,还有_________________________________________________________。
(3)下列给出了催化剂种类及用量对甲苯硝化反应影响的实验结果。
| 催化剂 | 
| 硝化产物中各种异构体质量分数(%) | 总产率(%) |
| 对硝基甲苯 | 邻硝基甲苯 | 间硝基甲苯 |
| 浓H2SO4 | 1.0 | 35.6 | 60.2 | 4.2 | 98.0 |
| 1.2 | 36.5 | 59.5 | 4.0 | 99.8 |
| NaHSO4 | 0.15 | 44.6 | 55.1 | 0.3 | 98.9 |
| 0.25 | 46.3 | 52.8 | 0.9 | 99.9 |
| 0.32 | 47.9 | 51.8 | 0.3 | 99.9 |
| 0.36 | 45.2 | 54.2 | 0.6 | 99.9 |
| | | | | |
①NaHSO4催化制备对硝基甲苯时,催化剂与甲苯的最佳物质的量之比为________。
②由甲苯硝化得到的各种产物的含量可知,甲苯硝化反应的特点是_________________________________________________________。
③与浓硫酸催化甲苯硝化相比,NaHSO4催化甲苯硝化的优点有________________、________________。
-
[实验化学]
对硝基苯甲酸在医药、感光材料等工业中应用广泛。以对硝基甲苯等为原料制取对硝基苯甲酸(黄色结晶,熔点242 ℃,沸点约359 ℃,微溶于水,能升华。)的反应原理为:
 +Na2Cr2O7+4H2SO4―→
+Na2Cr2O7+4H2SO4―→ +Na2SO4+Cr2(SO4)3+5H2O
+Na2SO4+Cr2(SO4)3+5H2O
某小组以对硝基甲苯等物质为原料制取对硝基苯甲酸的实验装置如下图所示(加热和仪器固定装置均已略去),实验步骤如下:

步骤1:向250 mL三颈烧瓶中依次加入适量的对硝基甲苯、重铬酸钠粉末、水,并充分混合。在搅拌下,用滴液漏斗滴入适量浓硫酸后,加热0.5 h至反应液呈黑色。
步骤2:待反应混合物冷却后,和适量冰水充分混合,抽滤并用50 mL水分两次洗涤。将洗涤后的固体放入盛有适量5%硫酸溶液中,水浴加热10 min,冷却后抽滤。
步骤3:将抽滤后的固体溶于适量5%NaOH溶液中,50 ℃温热后抽滤,在滤液中加入少量活性炭,煮沸后趁热抽滤。将得到的滤液慢慢加入到盛有适量15%硫酸溶液的烧杯中,析出黄色沉淀,抽滤,冷水洗涤,干燥得粗产品。
(1) 在步骤1中“搅拌”是用电动搅拌器完成的,这样操作的好处有________、________。
(2) 在三颈烧瓶中,随着浓硫酸的加入,反应温度迅速上升,为使反应温度不致过高,必要时可采取的措施是________。
(3) 在步骤2中,抽滤所得固体的主要成分是________。抽滤装置所包含的仪器除减压系统外,还有________、________(填仪器名称)。
(4) 步骤3用NaOH溶液进行处理的作用主要是____。
用NaOH溶液处理后,需50 ℃温热后抽滤的原因是____。
(5) 制得的粗产品需要进一步精制(纯化),根据对硝基苯甲酸的有关性质可知,对其进行精制(纯化)可以用乙醇溶液完成,也可以采用________法完成。
-
甲酸是基本有机化工原料之一,广泛用于农药、皮革、染料、医药和橡胶等工业。
(1)工业上利用甲酸的能量关系转换图如图:
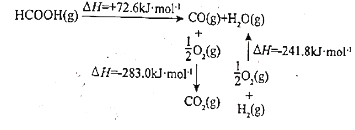
反应 的焓变
的焓变 ________
________ 。
。
(2)某科学小组研究不同压强条件对反应 的影响。
的影响。 下,在一个容积可变的密闭容器中,充入一定量的
下,在一个容积可变的密闭容器中,充入一定量的 和
和 ,测得不同压强下,平衡时容器内气体的浓度如下表:
,测得不同压强下,平衡时容器内气体的浓度如下表:
| 试验编号 | 反应压强 | 物质浓度 |
| 
| 
| 
|
| 1 | 
| 0.3 | 0.3 | 0.9 |
| 2 | 
| 
| 
| 0.4 |
| 3 | 
| 0.4 | 0.4 | 
|
试回答以下问题:
①平衡时,实验1的正反应速率________(填“>”、“<”或“=”)实验3的逆反应速率。
②由实验1的数据可计算 时,该反应的平衡常数
时,该反应的平衡常数 ________。
________。
③ ________
________ 。
。
(3)经研究发现采用电还原法也可将 转化为甲酸根,同时还能提高
转化为甲酸根,同时还能提高 的转换效率。其电解原理如图所示,下列叙述正确的是________。
的转换效率。其电解原理如图所示,下列叙述正确的是________。
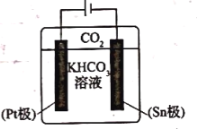
A. 极的电极反应式为
极的电极反应式为
B.电解过程中 向
向 极移动
极移动
C. 极发生还原反应并有气体逸出
极发生还原反应并有气体逸出
D.电解过程中 浓度逐渐减小
浓度逐渐减小
(4)甲酸的用途之一是用于配制“缓冲溶液”,在这种溶液中加入少量的强酸蚀碱,溶液的 变化不大,能保持溶液
变化不大,能保持溶液 相对稳定。(已知甲酸的电离平衡常数
相对稳定。(已知甲酸的电离平衡常数 )
)
①现将等浓度甲酸与甲酸钠溶液混合,配成 的
的 缓冲溶液。用离子方程式表示将少量强碱加入
缓冲溶液。用离子方程式表示将少量强碱加入 缓冲溶液中,
缓冲溶液中, 变化不大的原因是________。
变化不大的原因是________。
②若用 溶液配制
溶液配制 为4的缓冲溶液,需加入________
为4的缓冲溶液,需加入________ (答案保留一位小数)
(答案保留一位小数) 溶液。
溶液。
-
甲酸是基本有机化工原料之一,广泛用于农药、皮革、染料、医药和橡胶等工业。
(1)已知热化学反应方程式:
I:HCOOH(g) CO(g)+H2O(g) △H1=+72.6kJ•mol-1;
CO(g)+H2O(g) △H1=+72.6kJ•mol-1;
II:2CO(g)+O2(g) 2CO2(g) △H 2=-566.0kJ•mol-1;
2CO2(g) △H 2=-566.0kJ•mol-1;
III:2H2(g)+O2(g) 2H2O(g) △H 3=-483.6kJ•mol-1
2H2O(g) △H 3=-483.6kJ•mol-1
则反应IV:CO2(g)+H2(g) HCOOH(g)的△H =____________kJ•mol-1。
HCOOH(g)的△H =____________kJ•mol-1。
(2)查阅资料知在过渡金属催化剂存在下,CO2(g)和H2 (g)合成HCOOH(g)的反应分两步进行:第一步:CO2(g)+H2(g)+M(s)→M•HCOOH(s);第二步:___________________。
①第一步反应的△H _________0(填“>”或“<”)。
②第二步反应的方程式为________________________。
③在起始温度、体积都相同的甲、乙两个密闭容器中分别投入完全相同的H2(g)和CO2(g),甲容器保持恒温恒容,乙容器保持绝热恒容,经测定,两个容器分别在t1、t2时刻恰好达到平衡,则t1_________t2(填“>”、“<”或“=”)。
(3)在体积为1L的恒容密闭容器中,起始投料n(CO2)=1mol,以CO2(g)和H2(g)为原料合成HCOOH(g),HCOOH平衡时的体积分数随投料比[ ]的变化如图所示:
]的变化如图所示:
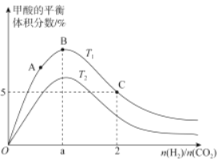
①图中T1、T2表示不同的反应温度,判断T1____________T2(填“〉”、“<”或“=” ) ,依据为____________________。
②图中a=______________。
③A、B、C三点CO2(g)的平衡转化率αA、αB、αC由大到小的顺序为____________。
④T1温度下,该反应的平衡常数K=______________(计算结果用分数表示)。
-
甲酸是基本有机化工原料之一,广泛用于农药、皮革、染料、医药和橡胶等工业。
(1)已知热化学反应方程式:
I:HCOOH(g) CO(g)+H2O(g) △H1=+72.6kJ•mol-1;
CO(g)+H2O(g) △H1=+72.6kJ•mol-1;
II:2CO(g)+O2(g) 2CO2(g) △H 2=-566.0kJ•mol-1;
2CO2(g) △H 2=-566.0kJ•mol-1;
III:2H2(g)+O2(g) 2H2O(g) △H 3=-483.6kJ•mol-1
2H2O(g) △H 3=-483.6kJ•mol-1
则反应IV:CO2(g)+H2(g) HCOOH(g)的△H =____________kJ•mol-1。
HCOOH(g)的△H =____________kJ•mol-1。
(2)查阅资料知在过渡金属催化剂存在下,CO2(g)和H2 (g)合成HCOOH(g)的反应分两步进行:第一步:CO2(g)+H2(g)+M(s)→M•HCOOH(s);第二步:___________________。
①第一步反应的△H _________0(填“>”或“<”)。
②第二步反应的方程式为________________________。
③在起始温度、体积都相同的甲、乙两个密闭容器中分别投入完全相同的H2(g)和CO2(g),甲容器保持恒温恒容,乙容器保持绝热恒容,经测定,两个容器分别在t1、t2时刻恰好达到平衡,则t1_________t2(填“>”、“<”或“=”)。
(3)在体积为1L的恒容密闭容器中,起始投料n(CO2)=1mol,以CO2(g)和H2(g)为原料合成HCOOH(g),HCOOH平衡时的体积分数随投料比[ ]的变化如图所示:
]的变化如图所示:
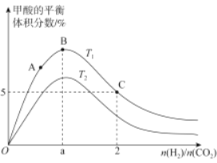
①图中T1、T2表示不同的反应温度,判断T1____________T2(填“〉”、“<”或“=” ) ,依据为____________________。
②图中a=______________。
③A、B、C三点CO2(g)的平衡转化率αA、αB、αC由大到小的顺序为____________。
④T1温度下,该反应的平衡常数K=______________(计算结果用分数表示)。
-
硝基苯是重要的精细化工原料,是医药和染料的中间体,还可做有机溶剂。制备硝基苯的过程如下:①配制混酸:组装如下图反应装置。
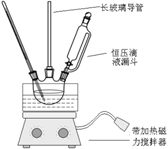
取100 mL烧杯,用20 mL浓硫酸与浓硝酸18 mL配制混和酸,加入漏斗中。把18 mL苯加入三颈烧瓶中。
②向室温下的苯中逐滴加入混酸,边滴边搅拌,混和均匀。
③在50-60℃下发生反应,直至反应结束。
④除去混和酸后,粗产品依次用蒸馏水和10%Na2CO3溶液洗涤,最后再用蒸馏水洗涤得到粗产品。
已知(1)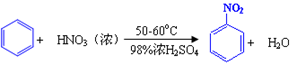
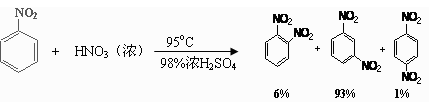
(2)可能用到的有关数据列表如下
| 物质 | 熔点/℃ | 沸点/℃ | 密度(20 ℃) / g·cm-3 | 溶解性 |
| 苯 | 5.5 | 80 | 0.88 | 微溶于水 |
| 硝基苯 | 5.7 | 210.9 | 1.205 | 难溶于水 |
| 1,3-二硝基苯 | 89 | 301 | 1.57 | 微溶于水 |
| 浓硝酸 | | 83 | 1.4 | 易溶于水 |
| 浓硫酸 | | 338 | 1.84 | 易溶于水 |
请回答下列问题:
(1)配置混酸应先在烧杯中先加入________。
(2)恒压滴液漏斗的优点是________。
(3)实验装置中长玻璃管可用________代替(填仪器名称)。
(4)反应结束后产品在液体的________层(填“上”或者“下”),分离混酸和产品的操作方法为________。
(5)用10%Na2CO3溶液洗涤之后再用蒸馏水洗涤时,怎样验证液体已洗净?________。
(6)为了得到更纯净的硝基苯,还须先向液体中加入________除去水,然后蒸馏,
-
对氨基苯甲酸(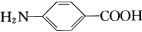 )是一种用途广泛的化工产品和医药中间体,以对硝基苯甲酸(
)是一种用途广泛的化工产品和医药中间体,以对硝基苯甲酸(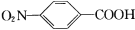 )为原料,采用电解法合成对氨基苯甲酸的装置如图。下列说法正确的是
)为原料,采用电解法合成对氨基苯甲酸的装置如图。下列说法正确的是
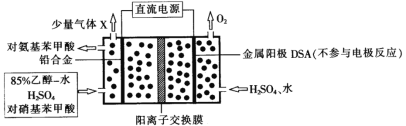
A.电子由金属阳极DSA经导线流入直流电源
B.阴极的主要电极反应式为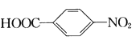 +6e-+6H+→
+6e-+6H+→ +2H2O
+2H2O
C.每转移1mole-时,阳极电解质溶液的质量减少8g
D.反应结束后阳极区pH增大
 )是一种广泛用于医药、染料、感光材料等的重要精细化工中间体。工业上以对硝基甲苯(
)是一种广泛用于医药、染料、感光材料等的重要精细化工中间体。工业上以对硝基甲苯( )、Cr(SO)3等物质为主要原料,通过间接电合成法制备对硝基苯甲酸,生产工艺流程如下:
)、Cr(SO)3等物质为主要原料,通过间接电合成法制备对硝基苯甲酸,生产工艺流程如下:













 )是一种用途广泛的化工产品和医药中间体,以对硝基苯甲酸(
)是一种用途广泛的化工产品和医药中间体,以对硝基苯甲酸( )为原料,采用电解法合成对氨基苯甲酸的装置如图。下列说法正确的是
)为原料,采用电解法合成对氨基苯甲酸的装置如图。下列说法正确的是
 +6e-+6H+→
+6e-+6H+→