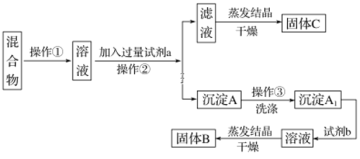
-
下列溶液中的氯离子浓度与50mL 1mol•L﹣1的FeCl3溶液中氯离子浓度相等的是
A. 150 mL 1 mol•L﹣1的NaCl B. 150 mL 3 mol•L﹣1的KCl
C. 75 mL 2 mol•L﹣1的NH4Cl D. 75 mL 2 mol•L﹣1的CaCl2
难度: 中等查看答案及解析
-
已知CO和CO2的混合气体质量共18.8g,标准状况下体积为11.2L,则可推知该混合物中CO和CO2的体积比为( )
A. 2:3 B. 3:2 C. 3:1 D. 1:3
难度: 中等查看答案及解析
-
进行化学实验时必须要有安全意识,下列做法正确的是( )
A. 加热装有碳酸氢钠固体的试管时,试管口向上倾斜
B. 滴瓶中的滴管用后不用清洗,直接放到滴瓶中
C. 做蒸馏实验时,如果加热液体时发现忘记加沸石,应立即补加沸石
D. 温度计摔坏导致水银散落到地面上,应立即用水冲洗水银
难度: 简单查看答案及解析
-
溶液、胶体和浊液这三种分散系的根本区别是( )
A.能否透过滤纸 B.能否发生丁达尔效应
C.是否均一、透明、稳定 D.分散质粒子的大小
难度: 简单查看答案及解析
-
若NA表示阿伏加德罗常数,下列说法中,正确的是( )
A.1 mol Cl2全部作为氧化剂时,失去的电子数为2NA个
B.在0 ℃,101 kPa时,22.4 L氢气中含有NA个氢原子
C.25 ℃,1.01×105 Pa,64 g SO2中含有的原子数为3 NA个
D.NA个一氧化碳分子和0.5 mol甲烷的质量比为7∶4
难度: 简单查看答案及解析
-
下列关于胶体的相关说法不正确的是( )
A. 向沸水中逐滴滴入饱和氯化铁溶液加热得红褐色液体,即为Fe(OH)3胶体
B. 向Fe(OH)3胶体中逐滴滴入稀硫酸,现象是先出现红褐色沉淀,后溶解转为黄色溶液
C. 江河入海口三角洲的形成通常与胶体的性质有关
D. 纳米材料微粒直径一般从几纳米到几十纳米(1 nm=10-9 m),因此纳米材料属于胶体
难度: 中等查看答案及解析
-
下列离子检验的方法正确的是 ( )
A.某溶液
有白色沉淀,说明原溶液中有Cl-
B.某溶液
生成无色无味气体,说明原溶液中有CO
C.某溶液
有蓝色沉淀,说明原溶液中有Cu2+
D.某溶液
有白色沉淀再加盐酸,沉淀不溶解,说明原溶液中有SO42-
难度: 中等查看答案及解析
-
常温下,在下列溶液中一定能大量共存的离子组是( )
A.强酸性的溶液:Na+、Fe2+、NO
、SO
B.滴加石蕊试剂呈红色的溶液:Na+、Al3+、SO
、Cl-
C.无色透明溶液:MnO
、SO
、K+、NO
D.强碱性的溶液:HCO
、NH
、Cl-、Ca2+
难度: 简单查看答案及解析
-
在配制一定物质的量浓度的溶液的实验中,下列操作正确的是
A.将NaOH固体放在天平托盘的称量纸上,精确称量并放入烧杯中溶解后,立即注入容量瓶中
B.将准确量取的18.4mol·L-1浓硫酸10mL,注入已盛有30 mL水的100 mL容量瓶中,加入至刻度线即可
C.仰视容量瓶刻度线,看到液面超过了容量瓶刻度线,用胶头滴管吸出刻度线以上的溶液
D.欲配制1000 mL 0.1 mol·L-1的盐酸,将稀释后的盐酸溶液全部转移到未经干燥的1000 mL的容量瓶中,加水至刻度线
难度: 困难查看答案及解析
-
下列表格中各项都正确的组是( )
碱
盐
电解质
非电解质
A
烧碱
小苏打
BaSO4
干冰
B
纯碱
CaCO3
NH3•H2O
Fe
C
明矾
食盐
石墨
醋酸
D
KOH
CuSO4
熔融MgCl2
氯水
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列离子方程式正确的是( )
A. 铁与稀硫酸反应:2Fe+6H+=2Fe3++3H2↑
B. 用氢氧化钠溶液吸收过量二氧化碳气体:CO2 +OH-=HCO3-
C. 制备氢氧化铁胶体:Fe3++3OH--Fe(OH)3↓
D. 醋酸除去水垢:2H+ +CaCO3=Ca2++CO2↑+H2O
难度: 中等查看答案及解析
-
已知MnO2为黑色难溶于水的固体,实验室制取氧气的反应为2KClO3
2KCl+3O2↑,反应后从剩余固体中回收二氧化锰的操作顺序正确的是( )
A. 溶解、过滤、蒸发、洗涤 B. 溶解、过滤、洗涤、加热
C. 溶解、蒸发、洗涤、过滤 D. 溶解、洗涤、过滤、加热
难度: 简单查看答案及解析
-
对于电解质的导电能力,下列说法正确的是
A.强电解质溶液的导电能力一定比弱电解质溶液的导电能力强
B.导电能力强的溶液一定是浓溶液
C.相同温度下,导电能力强的溶液中离子个数一定多
D.相同的温度下,单位体积中的离子个数越多,阴离子或阳离子所带电荷的绝对值越大,溶液的导电能力越强
难度: 中等查看答案及解析
-
已知在一定条件下能发生下列反应:N2+3Mg
Mg3N2(固),空气缓缓通过下图装置时,依次除去的气体是( )
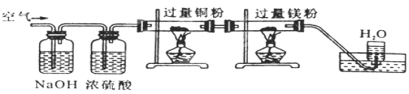
A.CO2、H2O、O2、N2 B.N2、O2、CO2、H2O
C.H2O、CO2、N2、O2 D.CO2、N2、H2O、O2
难度: 简单查看答案及解析
-
在Cl2+2Fe2+=2Cl-+2Fe3+的离子反应中,Fe2+代表的化合物不可以是( )
①Fe(OH)2 ②FeCl2 ③FeSO4 ④FeCO3
A.①④ B.①③ C.①③④ D.②
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.相同条件下,N2和O3混合气体与等体积的N2所含的原子数相同
B.等物质的量的CH5+和OH-所含电子数相等
C.常温常压下,28gCO与22.4LO2所含分子数相等
D.16gCH4与18gNH4+所含质子数相等
难度: 简单查看答案及解析
-
氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性质,被广泛应用于电子工业、陶瓷工业等领域。在一定条件下,氮化铝可通过如下反应合成:Al2O3+N2+3C 高温2AlN+3CO,下列叙述正确的是( )
A.氮化铝中氮元素的化合价为+3价
B.AlN的摩尔质量为41g
C.上述反应中每生成1 mol AlN,转移3 mol电子
D.在氮化铝的合成反应中,N2是还原剂,Al2O3是氧化剂
难度: 简单查看答案及解析
-
某溶液中含有Na+、Al3+、NO3-、SO42-(不考虑水中的H+、OH-)四种离子,已知Na+、Al3+、NO3-的个数比为3:2:1,则溶液中Al3+与SO42-的个数比为: ( )
A.1:2 B.1:4 C.3:4 D.3:2
难度: 简单查看答案及解析
-
将SO2气体与足量Fe2(SO4)3溶液完全反应后,再加入K2Cr2O7溶液,发生如下两个化学反应:SO2+2Fe3++2H2O = SO42−+4H++2Fe2+,Cr2O72−+6Fe2++14H+ = 2Cr3++6Fe3++7H2O。下列说法正确的是( )
A.还原性:Cr3+>Fe2+>SO2 B.氧化性:Cr2O72−>Fe3+>SO2
C.Cr2O72−不能将SO2氧化 D.两个反应中Fe2(SO4)3均作还原剂
难度: 中等查看答案及解析
-
若20g密度为ρg·cm-3的硝酸钙溶液里含1gCa2+,则NO
的物质的量浓度是
A.
mol·L-1 B.
mol·L-1
C.2.5ρmol·L-1 D.1.25ρmol·L-1
难度: 中等查看答案及解析