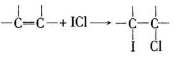-
化学与人类生产、生活密切相关,下列说法正确的是
A.蚕丝和棉
花的组成元素相同,结构不同,因而性质不同
B.汽车尾气中含有的氮氧化物,是汽油不完全燃烧造成的
C.古代的陶瓷、砖瓦、现代的玻璃、水泥等,都是硅酸盐产品
D.工业上通过电解熔融的氯化物制取Na、Mg、Al三种金属
难度: 简单查看答案及解析
-
下列有关说法正确的是
A. SO2可以使溴水褪色,所以SO2具有漂白性
B. SiO2是酸性氧化物,所以SiO2能与NaOH溶液反应
C. 若某碱性溶液的焰色呈黄色,则该溶液的溶质一定为NaOH
D. NH3的水溶液可以导电,所以NH3是电解质
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值。下列叙述正确的是
A.标准状况下,11.2 L SO3所含的氧原子数为1.5NA
B.电解精炼铜时,若阳极质量减少6.4 g,则电路中转移电子数为0.2NA
C.常温常压下,4.0 g CH4中含有共价键的数目为NA
D.在含Al3+总数为NA的AlCl3溶液中,Cl-总数为3NA
难度: 中等查看答案及解析
-
能正确表示下列反应的离子方程式是
A. 用过量石灰乳吸收工业尾气中的SO2: Ca2++2OH-+SO2=CaSO3 ↓+ H2O
B. 用酸性KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4—+6H++5H2O2=2Mn2++5O2 ↑+8H2O
C. 用铜做电极电解NaCl溶液:2C1—+2H2O
H2↑+Cl2↑+2OH-
D. 将 Fe2O3加入到 HI 溶液中:Fe2O3+ 6H+=2Fe3+ +3H2O
难度: 困难查看答案及解析
-
下列各组离子在指定溶液中一定能大量共存的是
A.能使甲基橙呈红色的溶液:Ba2+、Al3+、NO3—、Cl-
B.由水电离出的c(H+)=1×10-11 mol·L-1的溶液:Na+、Mg2+、Cl-、NO3—
C.0.2 mol·L-1的NaNO3溶液:H+、Fe2+、SO42—、Cl-
D.与Fe反应生成H2的溶液:NH4+、K+、SO42—、CO32—
难度: 中等查看答案及解析
-
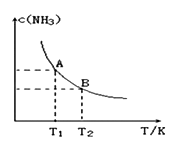
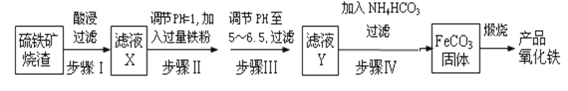
水热法制备Fe(FeO2)2纳米颗粒的反应3Fe2++2S2O32-+O2+xOH-=Fe(FeO2)2+S4O62-+2H2O,下列说法中不正确的是
A.每生成1molFe(FeO2)2转移4mol电子
B.该反应中Fe2+和S2O32-都是还原剂
C.3molFe2+被氧化时有1molO2被还原
D.反应方程式中化学计量数x=4
难度: 困难查看答案及解析
-
下列实验操作正确且能达到相应实验目的的是( )
实验目的
实验操作
A
称取2.0 g NaOH固体
先在托盘上各放1张滤纸,然后在右盘上添加2 g砝码,左盘上添加NaOH固体
B
配制FeCl3溶液
将FeCl3固体溶于适量蒸馏水
C
检验溶液中是否含NH4+
取少量试液于试管中,加入NaOH溶液并加热,用湿润的红色石蕊试纸检验产生的气体
D
验证铁的吸氧腐蚀
将铁钉放入试管中,用盐酸浸没
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
科学家宣布发现了铝的“超级原子”结构———Al13和Al14。 已知这类“超级原子”最外层电子数之和为40个时处于相对稳定状态。下列说法中,正确的是
A. Al13、Al14互为同位素
B. Al13超原子中Al原子间通过离子键结合
C. Al13和Al14都具有较强的还原性,容易失去电子生成阳离子
D. Al14最外层电子数之和为42,与第ⅡA族元素原子的性质相似
难度: 中等查看答案及解析
-
下表所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是
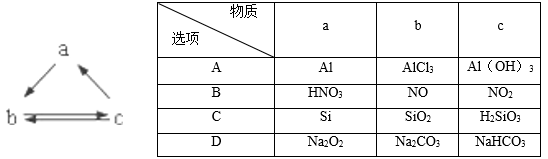
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列制备和收集气体的实验装置合理的是( )
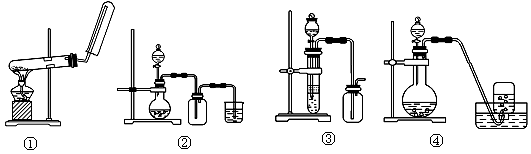
A.装置①:用氯化铵和氢氧化钙制NH3
B.装置②:用铜和稀硝酸制NO
C.装置③:用锌粒和稀硫酸制H2
D.装置④:用双氧水和二氧化锰制O2
难度: 中等查看答案及解析
-
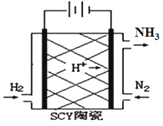
电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如下。下列说法不正确的是
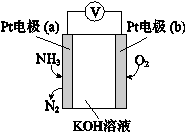
A.O2在电极b上发生还原反应
B.溶液中OH—向电极a移动
C.反应消耗的NH3与O2的物质的量之比为4:5
D.负极的电极反应式为:2NH3-6e—+6OH—=N2+6H2O
难度: 困难查看答案及解析
-
将15.6 g Na2O2和5.4 g Al同时放入一定量的水中,充分反应后得到200 mL溶液,再向该溶液中缓慢通入标准状况下的HCl气体6.72 L,若反应过程中溶液的体积保持不变,则下列说法正确的是
A. 标准状况下,反应过程中得到7.84 L的气体
B. 最终得到的溶液中c(Na+)=c(Cl-)+c(OH-)
C. 最终得到7.8 g的沉淀
D. 最终得到的溶液中c(Na+)=1.5 mol·L-1
难度: 困难查看答案及解析
-
短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等。下列判断不正确的是( )
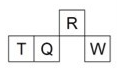
A. 最简单气态氢化物的热稳定性:R>Q
B. 最高价氧化物对应水化物的酸性:Q<W
C. 原子半径:T>Q>R
D. T的最高价氧化物对应的水化物不能和强碱反应
难度: 中等查看答案及解析
-
“人文奥运、科技奥运、绿色奥运”是2008年北京奥运会的重要特征。其中禁止运动员使用兴奋剂是重要举措之一。以下两种兴奋剂的结构分别为:
①利尿酸 ②兴奋剂X
则关于它们的说法中正确的是
A.利尿酸分子中有三种含氧官能团,在核磁共振氢谱上共有六个峰
B.1 mol兴奋剂X与足量浓溴水反应,最多消耗4 mol Br2
C.两种兴奋剂最多都能和含3molNaOH的溶液反应
D.两种分子中的所有碳原子均不可能共平面
难度: 中等查看答案及解析
-
下表是25℃时某些盐的溶度积常数和弱酸的电离平衡常数,下列说法正确的是
化学式
CH3COOH
H2CO3
AgCl
Ag2CrO4
Ka或Ksp
Ka=1.8×10﹣5
Ka1=4.1×10﹣7
Ka2=5.6×10﹣11
Ksp=1.8×10﹣10
Ksp=2.0×10﹣12
A. 常温下,相同浓度①CH3COONH4 ②NH4HCO3 ③(NH4)2CO3溶液中,c(NH4+)由大到小的顺序是:①>②>③
B. 向饱和氯水中滴加NaOH 溶液至溶液刚好为中性时,c(Na+)=2c(ClO﹣)+c(HClO)
C. AgCl 易溶于氨水难溶于水,所以AgCl 在氨水中的Ksp 大于水中的 Ksp
D. 向浓度均为1×10﹣3mol•L﹣1的KCl 和K2CrO4混合液中滴加1×10﹣3mol•L﹣1 的AgNO3溶液,CrO42﹣先形成沉淀
难度: 困难查看答案及解析
-
常温下,浓度均为0.10mol/L、体积均为V0的HA和HB溶液,分别加水稀释至体积V,pH随
的变化如图所示,下列叙述正确的是
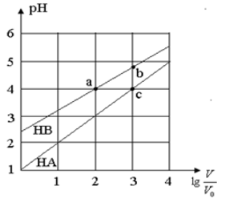
A.该温度下HB的电离平衡常数约等于1.11×10-5
B.相同条件下NaA溶液的pH大于NaB溶液的pH
C.溶液中水的电离程度:a=c>b
D.当
=3时,若两溶液同时升高温度,则
减小
难度: 困难查看答案及解析