-
下列关于元素周期表应用的说法正确的是
A. 为元素性质的系统研究提供指导,为新元素的发现提供线索
B. 在金属与非金属的交界处,寻找可做催化剂的合金材料
C. 在IA、IIA族元素中,寻找制造农药的主要元素
D. 在过渡元素中,可以找到半导体材料
难度: 简单查看答案及解析
-
常温下,在溶液中可发生以下反应:①2Fe2++Br2===2Fe3++2Br-,②2Br-+Cl2===Br2+2Cl-,③2Fe3++2I-===2Fe2++I2;下列说法错误的是
A.铁元素在反应①和③中均被氧化
B.反应②中当有1mol Cl2被还原时,有2mol Br-被氧化
C.氧化性强弱顺序为:Cl2>Br2>Fe3+>I2
D.还原性强弱顺序为:I->Fe2+>Br->Cl-
难度: 中等查看答案及解析
-
化学知识无处不在,下列与古诗文记载对应的化学知识不正确的是( )
常见古诗文记载
化学知识
A
《泉州府志》:元时南安有黄长者为宅煮糖,宅垣忽坏,去土而糖白,后人遂效之。
泥土具有吸附作用,能将红糖变白糖
B
《荀子·劝学》:冰水为之,而寒于水。
冰的能量低于水,冰变为水属于吸热反应
C
《本草纲目》:釆蒿蓼之属,晒干烧灰,以原水淋汁,久则凝淀如石(石碱),浣衣发面。
石碱具有碱性,遇酸产生气体
D
《天工开物》:凡研硝(KNO3)不以铁碾入石臼,相激火生,祸不可测。
性质不稳定,撞击易爆炸
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
运用元素周期律分析下面的推断,其中正确的是
A.铊(Tl)是铝的同族元素,原子核外有 6 个电子层,推测 Tl(OH)3 是两性氢氧化物
B.砹(At)为有色固体,HAt 不稳定
C.已知锶 Sr 与镁同族,硫酸锶(SrSO4)是易溶于水的白色固体
D.硒化氢(H2Se)是比硫化氢稳定的气体
难度: 中等查看答案及解析
-
已知反应X+Y= M+N为吸热反应,对这个反应的下列说法中正确的是( )
A.X的能量一定低于M的能量,Y的能量一定低于N的能量
B.X和Y的总能量一定低于M和N的总能量
C.破坏反应物中的化学键所吸收的能量小于形成生成物中化学键所放出的能量
D.因为该反应为吸热反应,故反应一定要加热才能进行
难度: 简单查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.强碱性溶液中:K+、Na+、CO32-、NO3-
B.加铝粉能产生大量H2的溶液中:Na+、NH4+、NO3-、Cl-
C.能使紫色石蕊变红的溶液中:Na+、A13+、SO42-、HCO3-
D.1.0 mol/LKNO3溶液:H+、Fe2+、Cl-、SO42-
难度: 中等查看答案及解析
-
下列不能说明氯元素的非金属性比硫元素强的事实是
①HCl比H2S稳定
②HClO氧化性比H2SO4强
③HClO4酸性比H2SO4强
④Cl2能与H2S反应生成S
⑤Cl原子最外层有7个电子,S原子最外层有6个电子
⑥Cl2与Fe反应生成FeCl3,S与Fe反应生成FeS.
A.②⑤ B.①②⑥ C.①②④ D.①③⑤
难度: 中等查看答案及解析
-
下列物质既含离子键又含共价键的是
A.CaCl2 B.H2O2
C.MgF2 D.NH4Cl
难度: 简单查看答案及解析
-
下列装置或操作能达到实验目的的是
A.实验Ⅰ:酸性KMnO4溶液中出现气泡,且颜色逐渐褪去
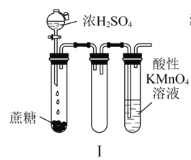
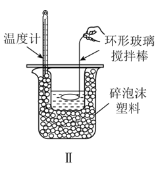
B.实验Ⅱ:中和热测定
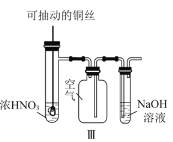
C.实验Ⅲ:可用来制取并收集NO2
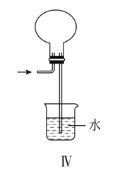
D.实验Ⅳ:可用于HCl气体的吸收
难度: 中等查看答案及解析
-
X、Y、Z、W、R是原子序数依次递增的短周期元素。X原子最外层电子数是其内层电子数的2倍,Y、R同主族,且两者核外电子数之和是X核外电子数的4倍,Z为短周期中金属性最强的元素,W是地売中含量最高的金属元素。下列叙述正确的是
A.Y、Z、W原子半径依次增大
B.元素W、Z形成的简单氧化物,W的氧化物熔点更高
C.X、Z、W的最高价氧化物对应水化物两两间均可发生反应
D.W、Z的最高价氧化物对应水化物碱性,W>Z
难度: 中等查看答案及解析
-
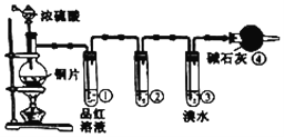
下图所示是验证氯气性质的微型实验,a、b、d、e是浸有相关溶液的滤纸。向KMnO4晶体滴加一滴浓盐酸后,立即用另一培养皿扣在上面。已知:2KMnO4+16HCl=2KCl+5Cl2↑+2MnCl2+8H2O
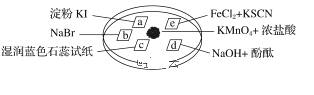
对实验现象的“解释或结论”正确的是( )
选项
实验现象
解释或结论
A
a处变蓝,b处变红棕色
氧化性:Cl2>Br2>I2
B
c处先变红,后褪色
氯气与水生成了酸性物质
C
d处立即褪色
氯气与水生成了漂白性物质
D
e处变红色
还原性:Fe2+>Cl-
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
下列电子式或结构式错误的是
A.CCl4的电子式
B.NH4Br的电子式
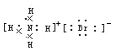
C.OH-的电子式
D.H2O的结构式为H-O-H
难度: 简单查看答案及解析
-
下列说法或表示法不正确的是
A.1mol硫蒸气与2mol硫蒸气完全燃烧时,燃烧热相同
B.已知:2H2(g)+O2(g)=2H2O(l) △H=-571.6kJ·mol-1,则H2的燃烧热为285.8kJ·mol-1
C.在稀溶液中:H+(aq)+OH-(aq)=H2O(aq)△H=-57.3kJ·mol-1,若将含1molCH3COOH的醋酸溶液与含1molBa(OH)2的溶液混合,放出的热量小于57.3kJ
D.在101kPa、25℃时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)=2H2O(l) △H=+285.8kJ·mol-1
难度: 简单查看答案及解析
-
下列依据热化学方程式得出的结论正确的是
2C(s) +O2(g) =2CO (g) △H2则△H1<△H2
A.已知2SO2(g)+O2
2SO3(g) 为放热反应,则SO2的能量一定高于SO3的能量
B.已知C(石墨,s)==C(金刚石,s)△H>0,则金刚石比石墨稳定
C.已知H+(aq)+OH-(aq)=H2O(1)△H=-57.3kJ/mol,则任何酸碱中和反应的热效应均为57.3 kJ
D.已知2C(s) +2O2(g) =2 CO2(g)△H1
难度: 中等查看答案及解析
-
反应M+Z→Q(△H<0)分两步进行:①M+Z→X(△H>0),②X→Q(△H<0)。下列示意图中,能正确表示总反应过程中能量变化的是
A.
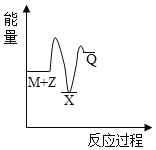 B.
B.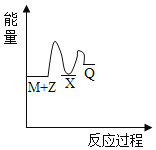
C.
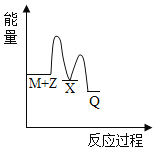 D.
D.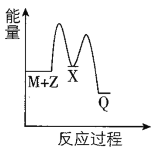
难度: 简单查看答案及解析