-
2020年6月5日世界环境日聚焦“生物多样性”,主题为“关爱自然,刻不容缓”。下列人类活动对该主题有积极作用的是( )
A.工业废水直接排放
B.将废旧电池深度填埋
C.加大化石燃料的直接利用
D.改进汽车尾气净化装置
难度: 简单查看答案及解析
-
反应NH4Cl+NaNO2═NaCl+N2↑+2H2O放热且产生气体,可用于冬天石油的开采。下列表示反应中相关微粒的化学用语正确的是( )
A.中子数为18的氯原子:
Cl
B.H2O的电子式:
C.Na+的结构示意图:
D.N2的结构式:N═N
难度: 简单查看答案及解析
-
下列物质中含有共价键的离子化合物的是( )
A.KOH B.Na2O C.CaCl2 D.HCl
难度: 简单查看答案及解析
-
下列反应是吸热反应的是( )
A.Ba(OH)2与稀硫酸反应
B.甲烷与O2的燃烧反应
C.炭与CO2反应
D.铝与稀盐酸反应
难度: 简单查看答案及解析
-
下列各组物质中属于同素异形体的一组是( )
A.1H、2H和3H B.金刚石和石墨
C.正丁烷和异丁烷 D.CO2和SiO2
难度: 简单查看答案及解析
-
下列有关物质的性质与用途具有对应关系的是( )
A.稀硫酸具有酸性,可用于除去铁锈
B.NH4HCO3受热易分解,可用作化肥
C.SO2具有氧化性,可用于纸浆漂白
D.Al2O3具有两性,可用于电解冶炼铝
难度: 简单查看答案及解析
-
联合国大会宣布2019年是“国际化学元素周期表年”。下列说法错误的是( )
A.短周期共有18种元素
B.目前元素周期表中已发现了118种元素,即发现了118种原子
C.在过渡元素中寻找各种优良的催化剂
D.每个周期都是按原子序数递增的顺序从左到右排列的
难度: 简单查看答案及解析
-
最近我国科研人员成功攻克了5G通信芯片制造中关键材料—氮化镓的研制难题。已知元素镓(Ga)与Al同主族,氮化镓中镓显最高正价,氮显最低负价。则氮化镓的化学式为( )
A.Ga2N3 B.GaN2 C.GaN D.Ga3N2
难度: 简单查看答案及解析
-
下列有关说法正确的是( )
A.需要加热的反应均是吸热反应
B.N2性质稳定,工业生产金属镁时,为防止其氧化,可以用N2作保护气
C.HCl气体溶于水的过程中,氯化氢分子内的共价键被破坏了
D.标准状况下,11.2LNH3分子中含有的原子数目约为0.5×6.02×1023
难度: 简单查看答案及解析
-
下列有关性质的比较正确的是( )
A.酸性:H3PO4<H2SO4<HClO4
B.非金属性:P>S>Cl
C.原子半径:P<S<Cl
D.稳定性:PH3>H2S>HCl
难度: 简单查看答案及解析
-
可逆反应2SO2+O2
2SO3在密闭容器中进行。下列说法正确的是( )
A.使用催化剂不能改变反应速率
B.达平衡时SO2与SO3的浓度相等
C.增大压强能加快反应速率
D.SO2与O2反应能完全转化为SO3
难度: 简单查看答案及解析
-
下列有关化学反应的叙述正确的是( )
A.MnO2和稀盐酸反应制取Cl2
B.过量氨水与SO2反应生成(NH4)2SO3
C.铁在浓硝酸中发生钝化
D.常温下钠与氧气反应生成Na2O2
难度: 简单查看答案及解析
-
下列各组离子中,能在溶液中大量共存的一组是( )
A.Al3+、NH4+、OH- B.Na+、Ba2+、SO42-
C.K+、Fe3+、I- D.K+、NO3-、HCO3-
难度: 简单查看答案及解析
-
恒温时,向2L密闭容器中通入一定量的气体X和Y,发生反应:3X(g)+Y(g)
2Z(g) ΔH>0。Y的物质的量n(Y)随时间t变化的曲线如图所示。下列说法正确的是( )
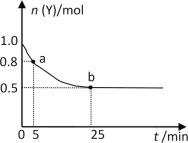
A.该反应为放热反应
B.0~5min内,以X表示的化学反应速率是0.02mol·L-1·min-1
C.b点时该反应达到了最大限度,反应停止
D.25min时,c(Z)=0.5mol·L-1
难度: 简单查看答案及解析
-
在给定条件下,下列选项所示的物质间转化均能实现的是( )
A.NH4HCO3
NH3
NO
B.N2
NO2
HNO3
C.Al
Al(NO3)3(aq)
Al(OH)3(aq)
D.S(s)
SO3(g)
H2SO4(aq)
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是( )
A.向水中通入NO2:2NO2+H2O=2H++NO3-+NO
B.向Cu(NO3)2溶液中加入氨水:Cu2++2OH-=Cu(OH)2↓
C.向Fe(NO3)3溶液中加入少量铁粉:2Fe3++Fe=3Fe2+
D.铝与氢氧化钠溶液的反应:Al+2OH-=AlO2-+H2↑
难度: 简单查看答案及解析
-
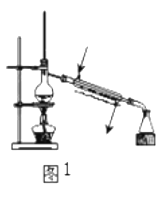
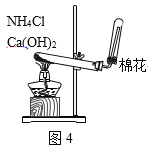
下列装置或操作能达到实验目的的是( )
A.图1用于实验室制取少量蒸馏水
B.图2用于收集NO
C.图3用于分离乙醇和水的混合物
D.图4用于实验室制取NH3
难度: 简单查看答案及解析