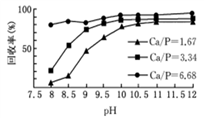
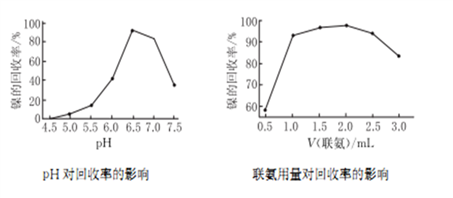
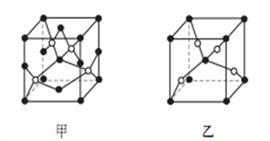
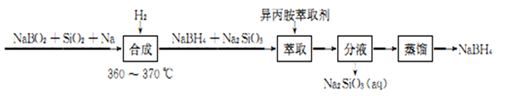
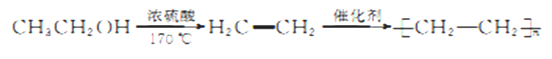-
化学与生产、生活密切相关,下列有关说法正确的是
A. 沼气是可再生资源,电能是二次能源
B. 对“地沟油”进行蒸馏即可得到汽油
C. 用焦炭还原铝土矿即可获得金属铝
D. 从海水提取物质都必须通过化学反应方可实现
难度: 中等查看答案及解析
-
乙炔气经CaCl2等净化处理后.在氮气氛围中可催化聚合为聚乙炔,有关表示错误的是
A. 质子数与中子数均为20的钙原子:
Ca B. 氮分子的电子式::N:::N:
C. 氯离子(Cl-)的结构示意图:
D. 聚乙炔的结构简式:
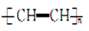
难度: 中等查看答案及解析
-
下列有关物质的性质与用途具有对应关系的是
A. 医用酒精能使蛋白质变性,可用于消毒杀菌
B. SiO2有很好的折光率,可以用来做半导体材料
C. 水玻璃易溶于水,可用于生产黏合剂和防火剂
D. 氯化铝是强电解质,可电解其水溶液获得金属铝
难度: 中等查看答案及解析
-
短周期元素W、X、Y和Z的原子序数依次增大,元素W是制备一种高效电池的重要材料, X原子的最外层电子数是内层电子数的2倍,元素Y是地壳中含量最丰富的金属元素,Z原子的最外层电子数是其电子层数的2倍。下列说法错误的是
A. 元素Z可与元素X形成共价化合物XZ2
B. 元素X与氢形成的原子比为1:1的化合物有很多种
C. 元素W、X的氯化物中,各原子均满足8电子的稳定结构
D. 元素Y的单质与氢氧化钠溶液或盐酸反应均有氢气生成
难度: 中等查看答案及解析
-
下列指定反应的离子方程式正确的是
A. 铝溶于氢氧化钠溶液:Al + 2OH-+H2O=A1O2- + 2H2↑
B. 用H2O2从酸化的海带灰浸出液中提取碘:2I-+H2O2 =I2+2OH-
C. 将等体积等物质的量浓度的NaHCO3溶液与Ba(OH)2溶液混合:HCO3-+Ba2++OH-= BaCO3↓+H2O
D. 向苯酚钠溶液中通入少量的CO2:
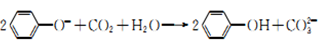
难度: 困难查看答案及解析
-
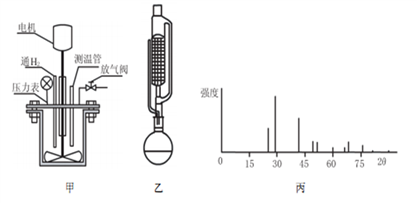
从海带中提取碘应该包括灼烧、溶解、过滤、氧化、萃取、蒸馏等过程。下列有关图示操作正确的是( )
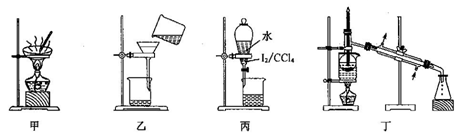
A. 用装置甲将海带灼烧成灰 B. 用装置乙过滤得含I-的溶液
C. 用装置丙分离出碘的CCl4溶液 D. 用装置丁蒸馏获得碘并回收CCl4
难度: 中等查看答案及解析
-
下列说法正确的是
A. Na与H2O的反应是熵增的放热反应,该反应能自发进行
B. 常温下,NH4Cl溶液加水稀释,
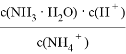 增大
增大C. 0.1 mol·L-1NaCN溶液中含 HCN和CN-总数目为0.1×6.02×1023
D. FeCl3和MnO2均可加快H2O2分解,同等条件下二者对H2O2分解速率的改变相同
难度: 困难查看答案及解析
-
清华大学王晓琳教授首创三室棋电解法制备LiOH,其工作原理如下图所示,下列说法正确的是
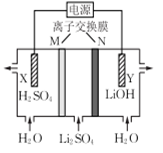
A. X电极连接电源负极
B. N为阳离子交换膜
C. Y电极反应式为O2+2H2O+4e-=4OH-
D. 制备2.4 g LiOH产生的H2在标准状况下为2.24 L
难度: 困难查看答案及解析
-
在一定条件下,X既能与Y反应又能与Z反应,且都属于复分解反应的是
选项
X
Y
Z
A
Cu
HNO3
Fe(NO3)3
B
FeCl3
Zn
NaHCO3
C
O2
NH3
SO2
D
NH4Al(SO4)2
Ba(NO3)2
NaOH
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列说法正确的是
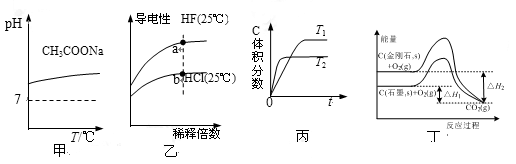
A.由图甲可知,升高温度醋酸钠的水解程度增大
B.由图乙可知,a点Kw的数值比b点Kw的数值大
C.由图丙可知,反应A(g)+B(g)
2C(g)是吸热反应
D.由图丁可知,反应C(金刚石,s)= C(石墨,s)的焓变△H=△H1—△H2
难度: 困难查看答案及解析
-
化合物M具有广谱抗菌活性,合成M的反应可表示如下:
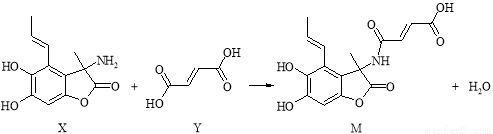
下列说法正确的是
A. X分子中有2个手性碳原子
B. Y分子中所有原子一定不可能在同一平面内
C. 可用FeCl3溶液或NaHCO3溶液鉴别X和Y
D. 在NaOH溶液中,1 mol M最多可与5 mol NaOH发生反应
难度: 困难查看答案及解析
-
25℃时,下列各组离子在指定溶液中一定能大量共存的是
A. 无色澄清透明溶液中:H+、Cu2+、SO42-、Cl-
B. 0.1 mol·L-1AlCl3溶液中:H+、Na+、Cl-、SO42-
C. pH = 13的溶液中:NH4+、K+、NO3-、HCO3-
D. c((OH-) <
的溶液:Ca2+、Fe2+、NO3-、ClO-
难度: 中等查看答案及解析
-
根据下列实验操作和现象所得到的结论正确的是
选项
实验操作和现象
结论
A
在酒精灯上加热铝箔,铝箔熔化但不滴落
熔点:铝>氧化铝
B
向某溶液中先滴加KSCN溶液,再滴加少量氯水,先无明显现象,后溶液变成血红色
原溶液中含有Fe3+,没有Fe2-
C
KNO3和KOH混合溶液中加入铝粉并加热,管口放湿润的红色石蕊试纸,试纸变为蓝色
NO3-还原为NH3
D
向加入了几滴酚酞试液的Na2CO3溶液中滴加BaCl2溶液,红色逐渐褪去
Na2CO3溶液中存在水解平衡
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
常温下,向20.00 mL 0.1000 mol·L—1 (NH4)2SO4溶液中逐滴加入0.2000 mol·L—1NaOH时,溶液的pH与所加NaOH溶液体积的关系如下图所示(不考虑挥发)。下列说法正确的是
A.点a所示溶液中:c(NH4+)>c(SO42-)>c(H+)>c(OH-)
B.点b所示溶液中:c(NH4+)=c(Na+)>c(H+)=c(OH-)
C.点c所示溶液中:c(SO42-)+ c(H+)= c(NH3·H2O )+ c(OH-)
D.点d所示溶液中:c(SO42-)>c(NH3·H2O )>c(OH-)>c(NH4+)
难度: 困难查看答案及解析
-
二甲醚是一种清洁燃料,以
=2通入1L的反应器中,一定条件下发生反应:2CO(g)+4H2(g)
CH3OCH3(g) +H2O(g) △H,其CO的平衡转化率随温度、压强变化关系如图所示,下列说法正确的是
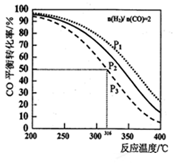
A.上述反应△H>0
B.图中P1<P2<P3
C.若在P3和316℃时,测得容器中n(H2)=n(CH3OCH3),此时v(正)<v(逆)
D.若在P3和316℃时,起始时
=3,则达到平衡时,CO转化率小于50%
难度: 困难查看答案及解析
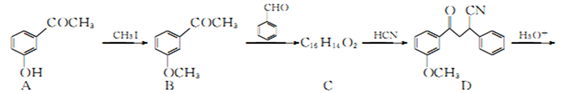

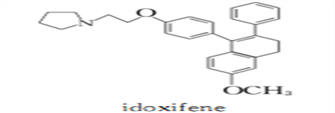
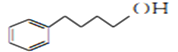 为原料制备化合物
为原料制备化合物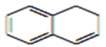 合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
合成路线流程图(无机试剂任用)。合成路线流程图示例如下: