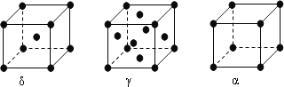
-
我国科技人员全球首创3290块长宽均为800毫米,重量仅为2.85公斤的可折叠光影屏助阵70周年国庆庆典。下列有关说法正确的是
A.光影屏中安装的计算机芯片,其材质是二氧化硅
B.为提升光影屏的续航能力,翻倍提高电池的能量密度
C.光影屏选用可折叠LED,其工作原理是将化学能转化为电能
D.为减轻光影屏的重量,选用的ABS工程塑料和碳纤维都是有机高分子材料
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值。下列说法正确的是
A.标准状况下,11.2LNO2中含有的氧原子数目为NA
B.1mol20Ne和22Ne的混合物中含有的中子数目为10NA
C.8.4gNaHCO3和MgCO3的混合物中含有的阴离子数目为0.1NA
D.已知某温度下硼酸(H3BO3)饱和溶液的pH=4.6,则溶液中H+的数目为1×10-4.6NA
难度: 中等查看答案及解析
-
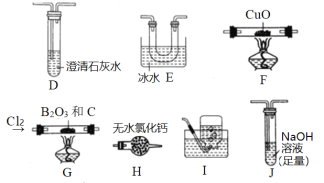
实验室用O2氧化NH3制备硝酸的装置如图所示(夹持装置略),下列说法不正确的是
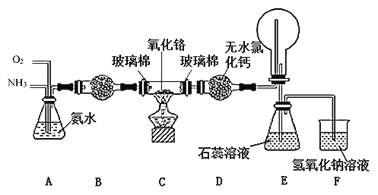
A.球形干燥管B中可以填充碱石灰或五氧化二磷
B.实验过程中,若熄灭酒精灯,装置C中的氧化铬继续保持红热,说明装置C中的反应放热
C.球形干燥管D中的无水氯化钙可吸收尾气中的氨气和水蒸气
D.装置E中的石蕊试液最终变红,说明锥形瓶中有硝酸产生
难度: 中等查看答案及解析
-
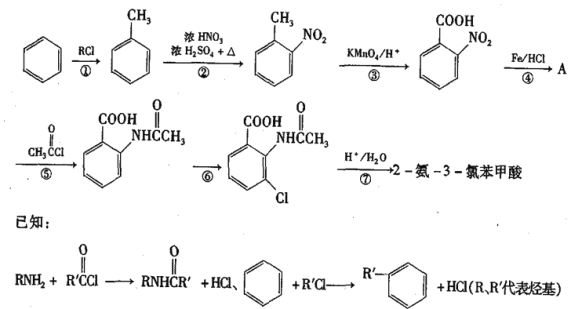
叶蜡石是一种重要的化工原料,化学式为X2[Y4Z10](ZW)2,X、Y、Z、W均为短周期元素,X与Y为同一周期相邻元素,Y的最外层电子数为次外层的一半,X 为地壳中含量最多的金属元素,X的离子与ZW-含有相同的电子数。下列说法正确的是
A. 原子半径:Y>X>Z>W
B. 最简单氢化物的沸点:Y>Z
C. X 与W形成的[XW4]-具有较强的还原性
D. 可用NaOH 溶液分离X、Y的最高价氧化物的混合物
难度: 中等查看答案及解析
-
下列各组离子在指定溶液中一定能大量共存的是
A.在pH=2的溶液中:NH4+、K+、F-、NO3-
B.使红色石蕊试纸变蓝的溶液中:Na+、K+、Cl-、ClO-
C.无色溶液中:Na+、NH4+、HCO3-、AlO2-
D.中性溶液中:Fe3+、Al3+、NO3-、SO42-
难度: 中等查看答案及解析
-
十九大报告中提出要“打赢蓝天保卫战”,意味着对大气污染防治比过去要求更高。二氧化硫-空气质子交换膜燃料电池实现了制硫酸、发电、环保三位一体的结合,原理如图所示。下列说法正确的是
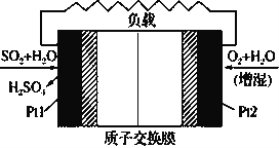
A.该电池放电时H+从Pt2电极经过内电路流到Pt1电极
B.Pt1电极附近发生的反应:SO2+2H2O-2e-=H2SO4+2H+
C.Pt2电极附近发生的反应为: O2+2H2O+4e-=4OH-
D.放电过程中若消耗的22.4L O2(标准状况),Pt1电极区增加4mol H+
难度: 中等查看答案及解析
-
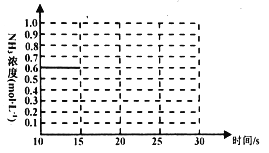
常温下,向20mL0.1 mol/L Na2CO3溶液中逐滴加入0.1 mol/LHCl溶液40mL,溶液中含碳元素的各种微粒(CO2逸出未画出)的物质的量分数随溶液pH变化的部分情况如图所示,下列说法错误的是( )
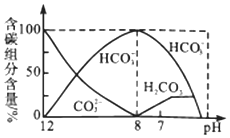
A.在同一溶液中,H2CO3、HCO3-、CO32-不能大量共存
B.已知在25℃,CO32-的水解平衡常数Kh1=2×10-4,当溶液的pH=10时,溶液中c(HCO3-):c(CO32-)=2:1
C.pH=7时溶液中各种离子其物质的量浓度的大小关系是c(Na+)>c(HCO3-)>c(Cl-)>c(H+)=c(OH-)>c(CO32-)
D.当混合液pH≈6时,开始放出CO2气体
难度: 中等查看答案及解析