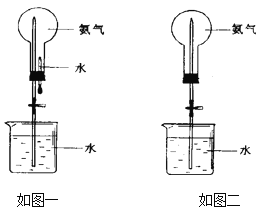
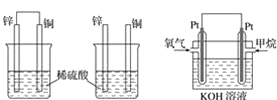
-
未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列符合未来新能源标准的有( )
①天然气 ②煤 ③核能 ④石油 ⑤太阳能 ⑥生物质能 ⑦风能 ⑧氢能
A.①②⑤⑥⑦ B.⑤⑥⑦⑧
C.③⑤⑥⑦⑧ D.③④⑤⑥⑦⑧
难度: 简单查看答案及解析
-
下列比较中正确的是( )
A.金属性:Al>Mg>Na
B.原子半径:S>O>F
C.酸性: HIO4>HBrO4>HClO4
D.氢化物的稳定性:HBr>HCl>PH3
难度: 简单查看答案及解析
-
试推测第 82 号元素 X 的单质及其化合物不可能具有的性质:
A.X 的氧化物的水化物可能有两种
B.单质是能导电的固体
C.单质不能与氢气直接化合
D.X 是非金属元素
难度: 中等查看答案及解析
-
下列离子方程式正确的是
A.足量铁屑溶于稀硝酸: Fe+2H+= 2Fe2++ H2↑
B.氯化铝溶液中加入过量的氨水:Al3+ + 4NH3·H2O =AlO2- + 4NH4++ 2H2O
C.NO2通入水中:3NO2 + H2O = 2H+ + 2NO3- + NO
D.实验室用加热铵盐和碱的固体混合物的方法制取氨:OH- + NH4+
NH3↑+ H2O
难度: 中等查看答案及解析
-
某兴趣小组设计如图所示装置进行原电池原理的探究,下列叙述错误的是( )
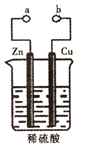
A. a和b用导线连接时,电子由Zn经导线流向Cu,再经稀硫酸流回Zn
B. a和b用导线连接时铜片为正极,发生的反应式为:2H++2e-=H2↑
C. a和b不连接时,锌片上有气体生成,该装置不能形成原电池
D. 无论a和b是否连接,稀硫酸均参与反应
难度: 中等查看答案及解析
-
下列各反应中,符合如图所示能量变化的是( )
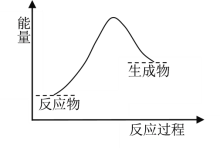
A.HCl和NaOH的反应
B.Al和盐酸的反应
C.甲烷在氧气中的燃烧反应
D.Ba(OH)2·8H2O和NH4Cl的反应
难度: 简单查看答案及解析
-
有X、Y、Z三种短周期元素,原子半径大小关系为r(Y)>r(X)>r(Z),原子序数之和为16。X、Y、Z三种元素的常见单质分子在适当条件下可发生如图变化,其中B和C均为10电子分子.下列说法中不正确的是
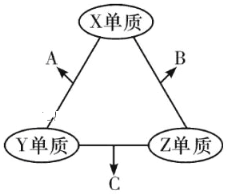
A.X与Z形成的某种化合物可用来杀菌消毒 B.C极易溶于B中,溶液呈碱性
C.Y与Z形成的二元化合物只含有极性键 D.A和C能发生氧化还原反应
难度: 困难查看答案及解析