-
下列各组离子在指定的溶液中能大量共存的是( )
①无色溶液中:K+、Cu2+、Na+、SO42﹣
②碱性溶液中:CO32﹣、Na+、AlO2﹣、NO3﹣
③酸性溶液中:Fe2+、Al3+、NO3﹣、Cl﹣
④加入Al能放出H2的溶液中:Cl﹣、HCO3﹣、NO3﹣、NH4+
⑤能使红色石蕊试纸变为蓝色的溶液:Na+、Cl﹣、S2﹣、ClO﹣
⑥含Fe2+的溶液中:Na+、Ba2+、Cl﹣、I﹣
A. ①② B. ②③ C. ②⑥ D. ②⑤⑥
难度: 中等查看答案及解析
-
下列各组物质相互混合反应后,最终有白色沉淀生成的是
①金属钠投入FeCl3溶液中; ②过量NaOH溶液和明矾溶液混合;
③少量Ca(OH)2投入过量NaHCO3溶液中; ④向AlCl3溶液中滴入NaHCO3溶液;
⑤向饱和Na2CO3溶液中通入足量CO2
A. ①③④⑤ B. 只有①④ C. 只有②③ D. 只有③④⑤
难度: 中等查看答案及解析
-
下列除去杂质的方法不正确的是
A. 镁粉中混有少量铝粉:加入过量烧碱溶液充分反应,过滤、洗涤、干燥
B. 用过量氨水除去Fe3+溶液中的少量Al3+
C. 用新制的生石灰,通过加热蒸馏,以除去乙醇中的少量水
D. 铜中混有铁粉:加过量硫酸铜溶液后过滤
难度: 中等查看答案及解析
-
在298K、100kPa时,已知:
2H2O(g)=2H2(g)+O2(g) △H1
H2(g)+Cl2(g)=2HCl(g) △H2
2Cl2(g)+2H2O(g)=4HCl(g)+O2(g) △H3
则△H3与△H1和△H2间的关系正确的是:
A.△H3=△H1+2△H2 B.△H3=△H1+△H2
C.△H3=△H1-2△H2 D.△H3=△H1-△H2
难度: 简单查看答案及解析
-
化学与社会、生活、生产密切相关。对下列现象或事实的解释正确的是
选项
现象或事实
解释
A
明矾用于净水
明矾具有消毒杀菌的作用
B
“地沟油”可以用来制生物柴油
其主要成分和从石油中提取的柴油类似
C
钢铁在海水中比在河水中更易腐蚀
海水中含氧量高于河水
D
含硫煤中加入适量石灰石可减少对大气的污染
使煤燃烧产生的SO2最终生成CaSO4
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的数值,下列说法正确的是
A. 2.1g丙烯中所含的共用电子对总数为0.3NA
B. 4.6gNO2和N2O4的混合气体中含有的氮原子数为0.1NA
C. 过氧化氢分解制得标准状况下2.24LO2,转移电子数目为0.4NA
D. 在高温高压、催化剂的条件下,56gN2和12gH2充分反应,生成NH3的分子数为4NA
难度: 困难查看答案及解析
-
A、B、C、D、E为原子序数依次增大的短周期主族元素,A原子的最外层电子数为内层电子数的2倍,B原子的M电子层有1个电子,C的氢氧化物既能与强酸反应又能与强碱反应,D的最高正价和最低负价的代数和为4,E在同周期主族元素中原子半径最小。下列叙述错误的是
A.元素C位于周期表中第三周期ⅢA族
B.熔融电解化合物CE3可制取单质C
C.D的最高价含氧酸的浓溶液与单质A共热时能生成三种氧化物
D.化合物B2D2中既含离子键又含非极性共价键
难度: 中等查看答案及解析
-
某反应由两步反应A→B→C构成,它的反应能量曲线如图(E1、E2、E3、E4表示活化能).下列有关叙述正确的是( )
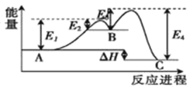
A.三种化合物中B最稳定 B.A→B为吸热反应,B→C为放热反应
C.加入催化剂会改变反应的焓变 D.整个反应的△H=E1﹣E2
难度: 简单查看答案及解析
-
我国科学家研发了一种室温下“可呼吸”的Na-CO2二次电池。将NaClO4溶于有机溶剂作为电解液,钠和负载碳纳米管的镍网分别作为电极材料,电池的总反应为:3CO2+4Na
2Na2CO3+C。下列说法错误的是( )
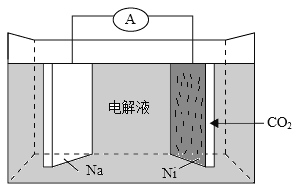
A.放电时,ClO4-向负极移动
B.充电时释放CO2,放电时吸收CO2
C.放电时,正极反应为:3CO2+4e-=2CO32-+C
D.充电时,正极反应为:Na++e-=Na
难度: 中等查看答案及解析
-
一定温度下,在1L恒容密闭容器中加入lmol的N2(g)和3molH2(g)发生反应:N2(g)+3H2(g)
2NH3(g) △H<0, NH3的物质的量与时间的关系如下表所示,下列说法不正确的是( )
时间(min)
0
t1
t2
t3
NH3物质的量(mol)
0
0.2
0.3
0.3
A.0~t1min,v(NH3)=0.2/t1mol·L-1·min-1
B.t3时再加入1mol的N2(g)和3molH2(g),反应达新平衡时,c(N2)>0.85mol·L-1
C.N2(g)+3H2(g)
2NH3(g)的活化能小于2NH3(g)
N2(g)+3H2(g)的活化能
D.升高温度,可使正反应速率减小,逆反应速率增大,故平衡逆移
难度: 中等查看答案及解析
-
处于平衡状态的反应:2H2S(g)
2H2(g)+S2(g) ΔH>0,不改变其他条件的情况下,下列叙述正确的是( )
A.加入催化剂,反应途径将发生改变,ΔH也将随之改变
B.升高温度,正、逆反应速率都增大,H2S分解率也增大
C.增大压强,平衡向逆反应方向移动,将引起体系温度降低
D.若体系恒容,注入一些H2后达新平衡,H2的浓度将减小
难度: 简单查看答案及解析
-
下图曲线a表示放热反应 X(g) + Y(g)
Z(g) + M(g) + N(s) △H <0进行过程中X的转化率随时间变化的关系。若要改变起始条件,使反应过程按b曲线进行,可采取的措施是( )
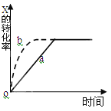
A.升高温度 B.加大X的投入量 C.加催化剂 D.增大体积
难度: 中等查看答案及解析
-
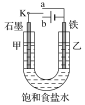
以H2、O2、熔融盐Na2CO3组成燃料电池,采用电解法制备 Fe(OH)2,装置如图所示,其中电解池两极材料分别为铁和石墨,通电一段时间后,右侧玻璃管中产生大量的白色沉淀。则下列说法正确的是( )
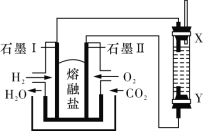
A.石墨电极Ⅱ处的电极反应式为O2+4e-===2O2-
B.X是铁电极
C.电解池中有1mol Fe溶解,石墨Ⅰ耗H2 22.4 L
D.若将电池两极所通气体互换,X、Y两极材料也互换,实验方案更合理。
难度: 中等查看答案及解析
-
常温下用惰性电极电解NaHSO4溶液,电解一段时间后,下列有关电解质溶液变化的说法正确的是( )
A.电解质溶液的浓度增大,pH减小
B.电解质溶液的浓度增大,pH增大
C.电解质溶液的浓度减小,pH减小
D.电解质溶液的浓度不变,pH不变
难度: 中等查看答案及解析
-
恒温恒压下,在容积可变的密闭容器中,反应2NO2(g)⇌ N2O4(g)达到平衡后,再向容器中通入一定量的NO2,又达到平衡时,N2O4的体积分数( )
A.不变 B.增大 C.减小 D.无法判断
难度: 中等查看答案及解析
-
在一定温度下的定容密闭容器中,发生反应:
。当下列所给有关量不再变化时,不能表明该反应已达平衡状态的是
A.混合气体的压强 B.混合气体的密度
C.混合气体的平均相对分子质量 D.
难度: 中等查看答案及解析
-
反应A(g)+3B(g)
2C(g)+2D(g)在四种不同情况下的反应速率如下,其中表示反应速率最快的是( )
A. v(A)=0.15 mol·L-1·min-1 B. v(B)=0.01 mol·L-1·s-1
C. v(C)=0.40 mol·L-1·min-1 D. v(D)=0.45 mol·L-1·min-1
难度: 中等查看答案及解析