-
氮的化合物在生产、生活中广泛存在。
(1)键能是将1mol理想气体分子AB拆开为中性气态原子A和B所需的能量。部分化学键的键能如下表:
| 化学键 | N≡N | O=O | N-N | N-H | O-H |
| 键能/kJ•mol-1 | 946 | 497 | 193 | 391 | 463 |
写出1mol气态肼(H2N-NH2)燃烧生成氮气和水蒸气的热化学方程式________________。
(2)用焦炭还原NO的反应为:2NO(g)+C(s)⇌ N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
| t/min | 0 | 10 | 20 | 30 | 40 |
| n(NO)(甲容器)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
| n(NO)(乙容器)/mol | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
| n(NO) (丙容器)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
①该反应为________(填“放热”或“吸热”)反应。
②乙容器在60min时达到平衡状态,则0~60min内用NO的浓度变化表示的平均反应速率υ(NO)=____________。
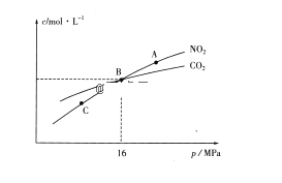
(3)用焦炭还原NO2的反应为:2NO2(g)+2C(s) ⇌N2(g)+2CO2(g),在恒温条件下,1molNO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
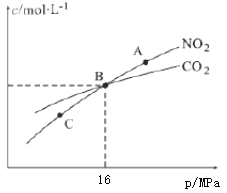
①A、C两点的浓度平衡常数关系:Kc(A)________Kc(C)(填“<”或“>”或“=”)。
②A、B、C三点中NO2的转化率最高的是________(填“A”或“B”或“C”)点。
-
氮的化合物在生产、生活中广泛存在。
(1)键能是将1mol理想气体分子AB拆开为中性气态原子A和B所需的能量。已知下列化学键的键能如下表:

写出1mol气态肼(H2N-NH2)燃烧生成氮气和水蒸气的热化学方程式________________。
(2)用焦炭还原NO的反应为:2NO(g)+C(s) N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
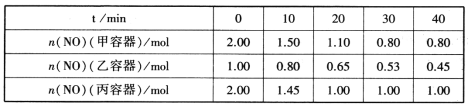
①该反应为________(填“放热”或“吸热”)反应。
②乙容器在60min时达到平衡状态,则0~60min内用NO的浓度变化表示的平均反应速率v(NO)=____________。
(3)用焦炭还原NO2的反应为:2NO2(g)+2C(s)  N2(g)+2CO2(g),在恒温条件下,1molNO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
N2(g)+2CO2(g),在恒温条件下,1molNO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
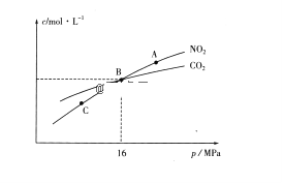
①A、C两点的浓度平衡常数关系:Kc(A)________Kc(C)(填“<”或“>”或“=”)。
②A、B、C三点中NO2的转化率最高的是________(填“A”或“B”或“C”)点。
-
氮的化合物在生产、生活中广泛存在。
(1)键能是将1mol理想气体分子AB拆开为中性气态原子A和B所需的能量。已知下列化学键的键能如下表:

写出1mol气态肼(H2N-NH2)燃烧生成氮气和水蒸气的热化学方程式________________。
(2)用焦炭还原NO的反应为:2NO(g)+C(s) N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
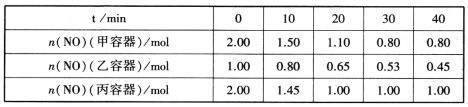
①该反应为________(填“放热”或“吸热”)反应。
②乙容器在60min时达到平衡状态,则0~60min内用NO的浓度变化表示的平均反应速率v(NO)=____________。
(3)用焦炭还原NO2的反应为:2NO2(g)+2C(s)  N2(g)+2CO2(g),在恒温条件下,1molNO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
N2(g)+2CO2(g),在恒温条件下,1molNO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
①A、C两点的浓度平衡常数关系:Kc(A)________Kc(C)(填“<”或“>”或“=”)。
②A、B、C三点中NO2的转化率最高的是________(填“A”或“B”或“C”)点。
-
(问8)已知:①S(g)+O2(g)═SO2(g)△H=-297.3kJ/mol.②键能是指常温常压下,将1mol气体分子拆开为气态原子所需要的能量.下列说法中错误的是( )
A.S(g)+O2(g)═SO2(l),|△H|>297.3 kJ/mol
B.S(s)+O2(g)═SO2(g),|△H|>297.3 kJ/mol
C.1 mol SO2的键能总和大于1 mol S和1 mol O2键能之和
D.1 mol SO2的总能量小于1 mol S和1 mol O2能量之和
-
SF6是一种优良的绝缘气体,分子结构中只存在S-F键.已知:1mol S(s)转化为气态硫原子吸收能量280kJ,断裂1mol F-F、S-F键需吸收的能量分别为160kJ、330kJ.则S(s)+3F2(g)═SF6(g)的反应热△H为( )
A.-1780kJ/mol
B.-1220 kJ/mol
C.-450 kJ/mol
D.+430 kJ/mol
-
SF6分子结构中只存在S﹣F键,是一种优良的绝缘气体,制备原理:S(s)+3F2(g)→SF6(g)+Q.已知:1mol S(s)转化为气态硫原子吸收能量280kJ,断裂1mol F﹣F、S﹣F键需吸收的能量分别为160kJ、330kJ.则反应热效应Q的值为(单位:kJ)( )
A.1780 B.1220 C.﹣1220 D.﹣1780
-
乙醇是生活中常见的物质,用途广泛,其合成方法和性质也具有研究价值。
Ⅰ.乙醇可以作为燃料燃烧。
已知化学键的键能是指气态原子间形成1mol化学键时释放出的能量。应用表中数据(25℃、101 kPa),写出气态乙醇完全燃烧生成CO2和水蒸气的热化学方程式_____________。
| 键 | C—C | C—H | O=O | H—O | C—O | C=O |
| 键能/(kJ•mol-1) | 348 | 413 | 498 | 463 | 351 | 799 |
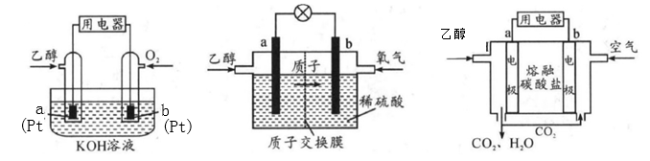
Ⅱ.直接乙醇燃料电池(DEFC)具有很多优点,引起了人们的研究兴趣。现有以下三种乙醇燃料电池。
碱性乙醇燃料电池酸性乙醇燃料电池熔融盐乙醇燃料电池
(1)三种乙醇燃料电池中正极反应物均为_________。
(2)碱性乙醇燃料电池中,电极a上发生的电极反应式为_________,使用空气代替氧气,电池工作过程中碱性会不断下降,其原因是_________。
(3)酸性乙醇燃料电池中,电极b上发生的电极反应式为_________,通过质子交换膜的离子是_________。
(4)熔融盐乙醇燃料电池中若选择熔融碳酸钾为介质,电池工作时,CO32-向电极_________(填“a”或“b”)移动,电极b上发生的电极反应式为_________。
Ⅲ.已知气相直接水合法可以制取乙醇:H2O(g) + C2H4(g)  CH3CH2OH(g)。当n(H2O)︰n(C2H4)=1︰1时,乙烯的平衡转化率与温度、压强的关系如下图:
CH3CH2OH(g)。当n(H2O)︰n(C2H4)=1︰1时,乙烯的平衡转化率与温度、压强的关系如下图:
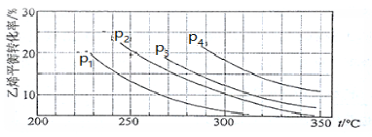
(1)图中压强P1、P2、P3、P4的大小顺序为:_________,理由是:_________。
(2)气相直接水合法采用的工艺条件为:磷酸/硅藻土为催化剂,反应温度290 ℃,压强6.9MPa,n(H2O)︰n(C2H4)=0.6︰1。该条件下乙烯的转化率为5℅。若要进一步提高乙烯的转化率,除了可以适当改变反应温度和压强外,还可以采取的措施有_________、_________。
Ⅳ.探究乙醇与溴水是否反应。
(1)探究乙醇与溴水在一定条件下是否可以发生反应,实验如下:
| 实验编号 | 实验步骤 | 实验现象 |
| 1 | 向4mL无水乙醇中加入1mL溴水,充分振荡,静置4小时 | 溶液橙黄色褪去,溶液接近无色 |
| 2 | 向4mL无水乙醇中加入1mL溴水,加热至沸腾 | 开始现象不明显,沸腾后溶液迅速褪色 |
| 向淀粉KI溶液中滴加冷却后的上述混合液 | 溶液颜色不变 |
| 3 | 向4mL水中加入1mL溴水,加热至沸腾 | 橙黄色略变浅 |
| 向淀粉KI溶液中滴加冷却后的溴水混合液 | 溶液变蓝 |
①实验2中向淀粉-KI溶液中滴加冷却后的混合液的目的是_________。
②实验3的作用是_________。
③根据实验现象得出的结论是_________。
(2)探究反应类型
现有含a mol Br2的溴水和足量的乙醇,请从定量的角度设计实验(其他无机试剂任选),探究该反应是取代反应还是氧化反应_________(已知若发生氧化反应,则Br2全部转化为HBr)。
-
碳和氮的化合物在生产、生活中广泛存在。请回答下列问题:
(1)资料显示,可用次氯酸钠处理废水中的氨氮 ,使其转化为氮气除去。其主要反应如下
,使其转化为氮气除去。其主要反应如下
I.



①以上反应中HClO的来源用化学用语解释是______。
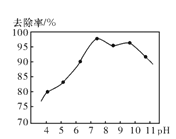
②实验测得。废水中pH与氨氮去除率的关系如图所示。pH较高时,氨氮去除率下降的原因是___。
(2)甲酶是重要的化工原料,又可作为燃料,工业上可利用CO或 来生产燃料甲醇。已知制备甲醇的有关反应的化学方程式及其在不同温度下的化学平衡常数如下表所示。
来生产燃料甲醇。已知制备甲醇的有关反应的化学方程式及其在不同温度下的化学平衡常数如下表所示。
| 化学反应 | 平衡常数 | 温度/℃ |
| 500 | 700 | 800 |
| 
| 
| 
| 
| 
|
| 
| 
| 
| 
| 
|
| 
| 
| | | |
①下列措施能使反应 的平衡体系中
的平衡体系中 增大的是______
增大的是______ 填字母代号
填字母代号 。
。
A.将 从体系中分离出去
从体系中分离出去  充入
充入 ,使体系压强增大
,使体系压强增大
C.升高温度  恒容时再充入1mol
恒容时再充入1mol 

②500℃时测得反应 在某时刻
在某时刻 、
、 、
、 、
、 的浓度分別为
的浓度分別为 、
、 、
、 、
、 ,则此时
,则此时 正
正 ______
______  填“
填“ ”“
”“ ”或“
”或“ ”
” v
v  逆
逆 。
。
(3)常温下,在 溶液中,反应
溶液中,反应 的化学平衡常数
的化学平衡常数 ______。
______。 已知:常温下,
已知:常温下, 的电离平衡常数
的电离平衡常数 ,
, 的电离衡常数
的电离衡常数 、
、
(4)电解硝酸上业的尾气NO可制备 ,其工作原理如图所示:
,其工作原理如图所示:
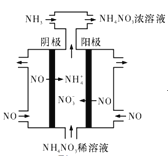
①阴极的电极反应式为______。
②将电解生成的 全部转化为
全部转化为 ,则通入的
,则通入的 与实际参加反应的NO的物质的量之比至少为___。
与实际参加反应的NO的物质的量之比至少为___。
-
碳、氮及其化合物在生产、生活中广泛存在。
(1)煤气化的化学方程式为:C(s)+H2O(g)==CO(g)+H2(g) ∆H,该反应在高温下能自发进行,则∆H_____0(填“>”或“<”)。
(2)煤气化的产物可用于合成甲醇。已知,在刚性容器中,有关反应及其在不同温度下的化学平衡常数如下表所示。
| 相关化学反应方程式 | 平衡 常数 | 温度(0C) |
| 500 | 700 | 800 |
| (a)2H2(g)+CO(g) CH3OH(g) ∆H1 CH3OH(g) ∆H1 | K1 | 2.5 | 0.34 | 0.15 |
| (b)H2(g)+CO2(g) H2O(g)+CO(g) ∆H2 H2O(g)+CO(g) ∆H2 | K2 | 1.0 | 1.70 | 2.52 |
| (c)3H2(g)+CO2(g) CH3OH(g)+H2O(g) ∆H3 CH3OH(g)+H2O(g) ∆H3 | K3 | | | |
①∆H1、∆H2、∆H3的关系是_____________,∆H3______0 (填“>”或“<”)
②下列措施能使反应(c)的平衡体系中n(CH3OH):n(CO2)增大的是_______(填字母代号)。
A.将H2O (g)从体系中分离出去 B.充入He (g)
C.升高温度 D.充入1mol H2 (g)
③500℃时,测得反应(c)在某时刻H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度分別为1.0mol·L-1、0.20mol·L-1、0.50mol·L-1、0.40mol·L-1,则此时反应(c)________。
A.向正反应方向进行 B.向逆反应方向进行
C.处于平衡状态 D.无法判断反应状态
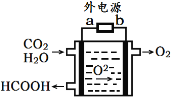
(3)CO2在熔融氧化钴环境和催化剂作用下可转化为清洁燃料甲酸。工作原理如图所示,写出阴极的电极反应____________________________。

(4)汽车尾气主要有害物质是CO和NO,提高其转化效率是重要的研究课题。在密闭容器中充入5.0 mol CO和4.0 mol NO,发生以下反应:2CO(g)+2NO(g) N2(g)+2CO2(g) △H = -746 kJ·mol-1平衡时,NO的转化率与温度、压强的关系如图所示。
N2(g)+2CO2(g) △H = -746 kJ·mol-1平衡时,NO的转化率与温度、压强的关系如图所示。

①温度:T1_____T2(填“<”或“>”),
② 某温度下,反应达到平衡状态P点时,此时的平衡常数Kp=________________________(只列计算式)。
-
碳、氮及其化合物在生产、生活中广泛存在。
(1)煤气化的化学方程式为:C(s)+H2O(g)==CO(g)+H2(g) ∆H,该反应在高温下能自发进行,则∆H_____0(填“>”或“<”)。
(2)煤气化的产物可用于合成甲醇。已知,在刚性容器中,有关反应及其在不同温度下的化学平衡常数如下表所示。
| 相关化学反应方程式 | 平衡 常数 | 温度(0C) |
| 500 | 700 | 800 |
| (a)2H2(g)+CO(g) CH3OH(g) ∆H1 CH3OH(g) ∆H1 | K1 | 2.5 | 0.34 | 0.15 |
| (b)H2(g)+CO2(g) H2O(g)+CO(g) ∆H2 H2O(g)+CO(g) ∆H2 | K2 | 1.0 | 1.70 | 2.52 |
| (c)3H2(g)+CO2(g) CH3OH(g)+H2O(g) ∆H3 CH3OH(g)+H2O(g) ∆H3 | K3 | | | |
①∆H1、∆H2、∆H3的关系是_____________,∆H3______0 (填“>”或“<”)
②下列措施能使反应(c)的平衡体系中n(CH3OH):n(CO2)增大的是_______(填字母代号)。
A.将H2O (g)从体系中分离出去 B.充入He (g)
C.升高温度 D.充入1mol H2 (g)
③500℃时,测得反应(c)在某时刻H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度分別为1.0mol·L-1、0.20mol·L-1、0.50mol·L-1、0.40mol·L-1,则此时反应(c)________。
A.向正反应方向进行 B.向逆反应方向进行
C.处于平衡状态 D.无法判断反应状态
(3)CO2在熔融氧化钴环境和催化剂作用下可转化为清洁燃料甲酸。工作原理如图所示,写出阴极的电极反应____________________________。
(4)汽车尾气主要有害物质是CO和NO,提高其转化效率是重要的研究课题。在密闭容器中充入5.0 mol CO和4.0 mol NO,发生以下反应:2CO(g)+2NO(g) N2(g)+2CO2(g) △H = -746 kJ·mol-1平衡时,NO的转化率与温度、压强的关系如图所示。
N2(g)+2CO2(g) △H = -746 kJ·mol-1平衡时,NO的转化率与温度、压强的关系如图所示。
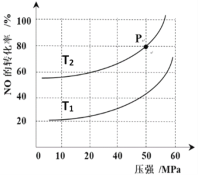
①温度:T1_____T2(填“<”或“>”),
② 某温度下,反应达到平衡状态P点时,此时的平衡常数Kp=________________________(只列计算式)。














