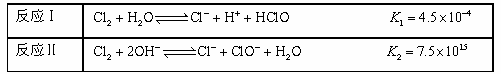-
碳、氮及其化合物在生产、生活中广泛存在。
(1)煤气化的化学方程式为:C(s)+H2O(g)==CO(g)+H2(g) ∆H,该反应在高温下能自发进行,则∆H_____0(填“>”或“<”)。
(2)煤气化的产物可用于合成甲醇。已知,在刚性容器中,有关反应及其在不同温度下的化学平衡常数如下表所示。
| 相关化学反应方程式 | 平衡 常数 | 温度(0C) |
| 500 | 700 | 800 |
| (a)2H2(g)+CO(g) CH3OH(g) ∆H1 CH3OH(g) ∆H1 | K1 | 2.5 | 0.34 | 0.15 |
| (b)H2(g)+CO2(g) H2O(g)+CO(g) ∆H2 H2O(g)+CO(g) ∆H2 | K2 | 1.0 | 1.70 | 2.52 |
| (c)3H2(g)+CO2(g) CH3OH(g)+H2O(g) ∆H3 CH3OH(g)+H2O(g) ∆H3 | K3 | | | |
①∆H1、∆H2、∆H3的关系是_____________,∆H3______0 (填“>”或“<”)
②下列措施能使反应(c)的平衡体系中n(CH3OH):n(CO2)增大的是_______(填字母代号)。
A.将H2O (g)从体系中分离出去 B.充入He (g)
C.升高温度 D.充入1mol H2 (g)
③500℃时,测得反应(c)在某时刻H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度分別为1.0mol·L-1、0.20mol·L-1、0.50mol·L-1、0.40mol·L-1,则此时反应(c)________。
A.向正反应方向进行 B.向逆反应方向进行
C.处于平衡状态 D.无法判断反应状态
(3)CO2在熔融氧化钴环境和催化剂作用下可转化为清洁燃料甲酸。工作原理如图所示,写出阴极的电极反应____________________________。

(4)汽车尾气主要有害物质是CO和NO,提高其转化效率是重要的研究课题。在密闭容器中充入5.0 mol CO和4.0 mol NO,发生以下反应:2CO(g)+2NO(g) N2(g)+2CO2(g) △H = -746 kJ·mol-1平衡时,NO的转化率与温度、压强的关系如图所示。
N2(g)+2CO2(g) △H = -746 kJ·mol-1平衡时,NO的转化率与温度、压强的关系如图所示。

①温度:T1_____T2(填“<”或“>”),
② 某温度下,反应达到平衡状态P点时,此时的平衡常数Kp=________________________(只列计算式)。
-
碳、氮及其化合物在生产、生活中广泛存在。
(1)煤气化的化学方程式为:C(s)+H2O(g)==CO(g)+H2(g) ∆H,该反应在高温下能自发进行,则∆H_____0(填“>”或“<”)。
(2)煤气化的产物可用于合成甲醇。已知,在刚性容器中,有关反应及其在不同温度下的化学平衡常数如下表所示。
| 相关化学反应方程式 | 平衡 常数 | 温度(0C) |
| 500 | 700 | 800 |
| (a)2H2(g)+CO(g) CH3OH(g) ∆H1 CH3OH(g) ∆H1 | K1 | 2.5 | 0.34 | 0.15 |
| (b)H2(g)+CO2(g) H2O(g)+CO(g) ∆H2 H2O(g)+CO(g) ∆H2 | K2 | 1.0 | 1.70 | 2.52 |
| (c)3H2(g)+CO2(g) CH3OH(g)+H2O(g) ∆H3 CH3OH(g)+H2O(g) ∆H3 | K3 | | | |
①∆H1、∆H2、∆H3的关系是_____________,∆H3______0 (填“>”或“<”)
②下列措施能使反应(c)的平衡体系中n(CH3OH):n(CO2)增大的是_______(填字母代号)。
A.将H2O (g)从体系中分离出去 B.充入He (g)
C.升高温度 D.充入1mol H2 (g)
③500℃时,测得反应(c)在某时刻H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度分別为1.0mol·L-1、0.20mol·L-1、0.50mol·L-1、0.40mol·L-1,则此时反应(c)________。
A.向正反应方向进行 B.向逆反应方向进行
C.处于平衡状态 D.无法判断反应状态
(3)CO2在熔融氧化钴环境和催化剂作用下可转化为清洁燃料甲酸。工作原理如图所示,写出阴极的电极反应____________________________。
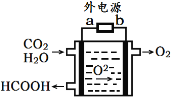
(4)汽车尾气主要有害物质是CO和NO,提高其转化效率是重要的研究课题。在密闭容器中充入5.0 mol CO和4.0 mol NO,发生以下反应:2CO(g)+2NO(g) N2(g)+2CO2(g) △H = -746 kJ·mol-1平衡时,NO的转化率与温度、压强的关系如图所示。
N2(g)+2CO2(g) △H = -746 kJ·mol-1平衡时,NO的转化率与温度、压强的关系如图所示。
①温度:T1_____T2(填“<”或“>”),
② 某温度下,反应达到平衡状态P点时,此时的平衡常数Kp=________________________(只列计算式)。
-
氮的化合物在生产、生活中广泛存在。
(1)键能是将1mol理想气体分子AB拆开为中性气态原子A和B所需的能量。已知下列化学键的键能如下表:

写出1mol气态肼(H2N-NH2)燃烧生成氮气和水蒸气的热化学方程式________________。
(2)用焦炭还原NO的反应为:2NO(g)+C(s) N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
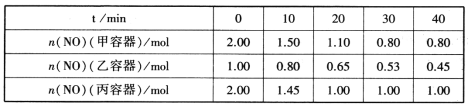
①该反应为________(填“放热”或“吸热”)反应。
②乙容器在60min时达到平衡状态,则0~60min内用NO的浓度变化表示的平均反应速率v(NO)=____________。
(3)用焦炭还原NO2的反应为:2NO2(g)+2C(s)  N2(g)+2CO2(g),在恒温条件下,1molNO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
N2(g)+2CO2(g),在恒温条件下,1molNO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
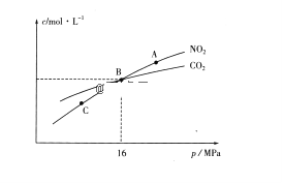
①A、C两点的浓度平衡常数关系:Kc(A)________Kc(C)(填“<”或“>”或“=”)。
②A、B、C三点中NO2的转化率最高的是________(填“A”或“B”或“C”)点。
-
氮的化合物在生产、生活中广泛存在。
(1)键能是将1mol理想气体分子AB拆开为中性气态原子A和B所需的能量。已知下列化学键的键能如下表:

写出1mol气态肼(H2N-NH2)燃烧生成氮气和水蒸气的热化学方程式________________。
(2)用焦炭还原NO的反应为:2NO(g)+C(s) N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
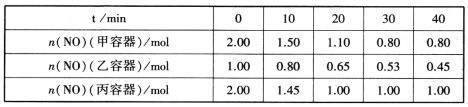
①该反应为________(填“放热”或“吸热”)反应。
②乙容器在60min时达到平衡状态,则0~60min内用NO的浓度变化表示的平均反应速率v(NO)=____________。
(3)用焦炭还原NO2的反应为:2NO2(g)+2C(s)  N2(g)+2CO2(g),在恒温条件下,1molNO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
N2(g)+2CO2(g),在恒温条件下,1molNO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
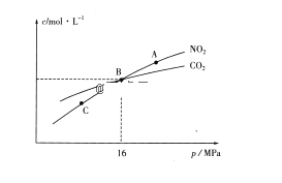
①A、C两点的浓度平衡常数关系:Kc(A)________Kc(C)(填“<”或“>”或“=”)。
②A、B、C三点中NO2的转化率最高的是________(填“A”或“B”或“C”)点。
-
在化工生产、污水处理中广泛涉及硫单质及其化合物。
Ⅰ.煤制得的化工原料中含有羰基硫(O===C===S),该物质可转化为H2S,主要反应如下:①水解反应:COS(g)+H2O(g) H2S(g)+CO2(g) ΔH1=-94 kJ·mol-1,②氢解反应:COS(g)+H2(g)
H2S(g)+CO2(g) ΔH1=-94 kJ·mol-1,②氢解反应:COS(g)+H2(g) H2S(g)+CO(g) ΔH2=-54 kJ·mol-1。
H2S(g)+CO(g) ΔH2=-54 kJ·mol-1。
(1)请计算CO(g)和H2O(g)生成H2(g)和CO2(g)的反应热ΔH=______。
(2)在定温定容的密闭容器中进行反应①,下列事实说明反应①达到平衡状态的是_____(填字母)。
A.容器的压强不再改变
B.混合气体的密度不再改变
C.化学平衡常数不再改变
D.生成1 mol H—O键,同时生成1 mol H—S键
(3)反应②的正、逆反应的平衡常数(K)与温度(T)的关系如图所示。在T1 ℃时,向容积为5 L的密闭容器中加入2 mol COS(g)和1 mol H2(g),充分反应,COS的平衡转化率为______。

Ⅱ.在容积为2 L的恒容密闭容器中,充入0.5 mol H2S(g),发生反应:2H2S(g)  2H2(g)+S2(g),在不同温度和压强下进行实验,结果如图所示。
2H2(g)+S2(g),在不同温度和压强下进行实验,结果如图所示。
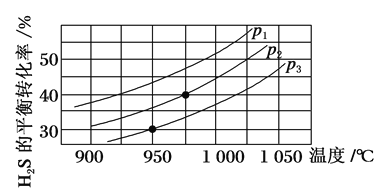
(4)图中压强p1、p2、p3由大到小的顺序是______。
(5)在950 ℃,压强为p3时,反应经30 min达到平衡,则平均反应速率v(H2)=_______。
(6)在p2=6 MPa,温度为975 ℃时,请计算该反应的平衡常数Kc为_____(保留2位有效数字)。对于气相反应,用某组分(B)的平衡分压(pB)代替物质的量浓度(cB)也可以表示平衡常数(记作Kp),pB=p总×B的物质的量分数,则此条件下该反应的平衡常数Kp=___MPa。
-
Cl2、漂白液(有效成分为NaClO)在生产、生活中广泛用于杀菌、消毒。
(1)电解NaCl溶液生成氯气的化学方程式为 。
(2)Cl2溶于H2O、NaOH溶液即获得氯水、漂白液。
①干燥的氯气不能漂白物质,但氯水却有漂白作用,说明起漂白作用的物质是 。
②25℃,Cl2与H2O、NaOH的反应如下:
| 反应Ⅰ | Cl2+H2O Cl-+H++HClO K1=4.5×10-4 Cl-+H++HClO K1=4.5×10-4 |
| 反应Ⅱ | Cl2+2OH- Cl-+ClO-+ H2O K2=7.5×1015 Cl-+ClO-+ H2O K2=7.5×1015 |
不直接使用氯水而使用漂白液做消毒剂的原因是 。
(3)家庭使用漂白液时,不宜直接接触铁制品,漂白液腐蚀铁的电极反应为:Fe-2e-=Fe2+;ClO发生的电极反应式是 。
(4)研究漂白液的稳定性对其生产和保存有实际意义.30℃时,pH=11的漂白液中NaClO的质量百分含量随时间变化如图所示:
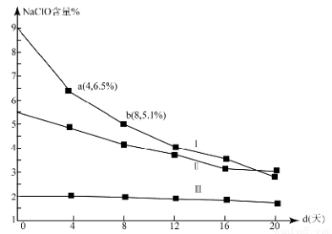
①分解速率v(Ⅰ) v(Ⅱ)(填“>”“<”或“=”),原因是 。
②NaClO分解的化学方程式是 。
③4d-8d,Ⅰ中v(NaClO)= mol/(L·d)(常温下漂白液的密度约为1g/cm3,且变化忽略不计)
-
(14分)
Cl2、漂白液(有效成分为NaClO)在生产、生活中广泛用于杀菌、消毒.
(1)电解NaCl溶液生成Cl2的化学方程式是 。
(2)Cl 2溶于H2O、NaOH溶液即获得氯水、漂白液.
①干燥的氯气不能漂白物质,但氯水却有漂白作用,说明起漂白作用的物质是 。
②25℃,Cl 2与H2O、NaOH的反应如下:
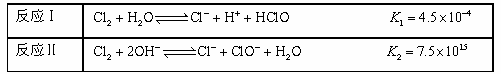
不直接使用氯水而使用漂白液做消毒剂的原因是 。
(3)家庭使用漂白液时,不宜直接接触铁制品,漂白液腐蚀铁的电极反应为: 发生的电极反应式是 。
发生的电极反应式是 。
(4)研究漂白液的稳定性对其生产和保存有实际意义.30℃时,pH=11的漂白液中NaClO的质量百分含量随时间变化如下:
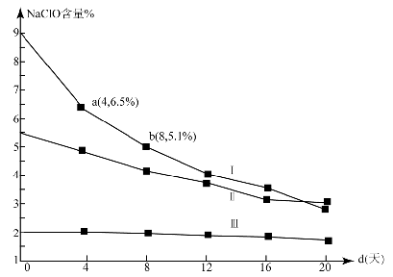
①分解速v(Ⅰ)、v(Ⅱ)的大小关系是 ,原因是 。
②NaClO分解的化学方程式是 。
③ (常温下漂白液的密度约为1g / cm3,且变化忽略不计)
(常温下漂白液的密度约为1g / cm3,且变化忽略不计)
-
淮南是我国重要的煤炭生产基地,通过煤的气化和液化,能使煤炭得以更广泛的应用。
I.工业上先将煤转化为CO,再利用CO和水蒸气反应制H2时,存在以下平衡:
CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
(1)向2L恒容密闭容器中充入CO和H2O(g),800℃时测得部分数据如下表。
| t/min | 0 | 1 | 2 | 3 | 4 |
| n(H2O)/mol | 1.20 | 1.04 | 0.90 | 0.70 | 0.70 |
| n(CO)/mol | 0.80 | 0.64 | 0.50 | 0.30 | 0.30 |
则从反应开始到2min时,用H2表示的反应速率为_________________;该温度下反应的平衡常数K=___________________(小数点后保留1位有效数字)。
(2)相同条件下,向2L恒容密闭容器中充入1molCO、3mol H2O(g)、2molCO2(g)、2mo1 H2(g),此时v正________v逆(填“>” “<” 或 “=”)。
Ⅱ.一定条件下用CO和H2合成CH3OH:CO(g)+2H2(g)⇌CH3OH(g)△H=﹣105kJ•mol﹣1.向体积为2L的密闭容器中充入2mol CO和4mol H2,测得不同温度下容器内的压强(P:kPa)随时间(min)的变化关系如右图中Ⅰ、Ⅱ、Ⅲ曲线所示:

(1)Ⅱ和Ⅰ相比,改变的反应条件是______.
(2)反应Ⅰ在6min时达到平衡,在此条件下从反应开始到达到平衡时v(CH3OH)=______.
(3)反应Ⅱ在2min时达到平衡,平衡常数K(Ⅱ)=______.
(4)比较反应Ⅰ的温度(T1)和反应Ⅲ的温度(T3)的高低:T1_____T3(填“>”“<”“=”),判断的理由是_________________________________________________________.
-
(16分)
通过煤的气化和液化,使碳及其化合物得以广泛应用。
I.工业上先用煤转化为CO,再利用CO和水蒸气反应制H2时,存在以下平衡:CO(g)+H2O(g)  CO2(g)+H2(g)
CO2(g)+H2(g)
(1)向1L恒容密闭容器中充人CO和H2O(g),800℃时测得部分数据如下表。
| t/min | 0 | 1 | 2 | 3 | 4 |
| n(H2O)/mol | 0.600 | 0.520 | 0.450 | 0.350 | 0.350 |
| n(CO)/mol | 0.400 | 0.320 | 0.250 | 0.150 | 0.150 |
则该温度下反应的平衡常数K= 。
(2)相同条件下,向2L恒容密闭容器中充入1molCO、1mol H2O(g)、2molCO2、2mo1 H2,
此时υ(正) υ(逆) (填“>” “=” 或 “<”)。
II.已知CO(g)、H2(g)、CH3OH(l)的燃烧热分别为283 kJ·mol-1、286 kJ·mol-1、726 kJ·mol-1'。
(3)利用CO、H2合成液态甲醇的热化学方程式为 。
(4)依据化学反应原理,分析增加压强对制备甲醇反应的影响 。
III。为摆脱对石油的过度依赖,科研人员将煤液化制备汽油,并设计了汽油燃料电池,电池工作原理如图所示:

一个电极通入氧气,另一电极通入汽油蒸气,电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2—。
(5)以辛烷(C8H18)代表汽油,写出该电池工作时的负极反应方程式 。
(6)已知一个电子的电量是1.602×10—19C,用该电池电解饱和食盐水,当电路中通过1.929×105C的电量时,生成NaOH g。
Ⅳ.煤燃烧产生的CO2是造成温室效应的主要气体之一。
(7)将CO2转化成有机物可有效地实现碳循环。如:
a.6CO2+6H2O C6H12O6+6O2
C6H12O6+6O2
b.2CO2 + 6H2 C2H5OH +3H2O
C2H5OH +3H2O
c.CO2 + CH4 CH3COOH
CH3COOH
d.2CO2 + 6H2 CH2=CH2 + 4H2O
CH2=CH2 + 4H2O
以上反应中,最节能的是 ,反应c中理论上原子利用率为 。
-
(16分)通过煤的气 化和液化,使碳及其化合物得以广泛应用。
化和液化,使碳及其化合物得以广泛应用。
I.工业上先用煤转化为CO,再利用CO和水蒸气反应制H2时,存在以下平衡:
CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
(1)向1L恒容密闭容器中充入CO和H2O(g),800℃时测得部分数据如下表。
| t/min | 0 | 1 | 2 | 3 | 4 |
| n(H2O)/mol | 0.600 | 0.520 | 0.450 | 0.350 | 0.350 |
| n(CO)/mol | 0.400 | 0.320 | 0.250 | 0.150 | 0.150 |
则该温度下反应的平衡常数K= 。(保留2位有效数字)
(2)相同条件下,向2L恒容密闭容器中充入1molCO、1mol H2O(g)、2molCO2、2mo1 H2,此时v (正)_____________ v (逆)(填“>” “=” 或 “<”)。
II.已知CO(g)、H2(g)、CH3OH(l)的燃烧热分别为283 kJ·mol-1、286 kJ·mol-1、726 kJ·mol-1。
(3)利用CO、H2合成液态甲醇的热化学方程式为 。
(4)依据化学反应原理,分析增加压强对制备甲醇反应的影响 。
III.为摆脱对石油的过度依赖,科研人员将煤液化制备汽油,并设计了汽油燃料电池,电池工作原理如右图所示:一个电极通入氧气,另一电极通入汽油蒸气,电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2—。
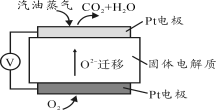
(5)以辛烷(C8H18)代表汽油,写出该电池工作时的负极反应方程式 。
(6)已知一个电子的电量是1.602×10—19C,用该电池电解饱和食盐水,当电路中通过1.929×105C的电量时,生成NaOH g。
Ⅳ.煤燃烧产生的CO2是造成温室效应的主 要气体之一。
要气体之一。
(7)将CO2转化成有机物可有效地实现碳循环。如:
a.6CO2+6H2O C6H12O6+6O2 b.2CO2 + 6H2
C6H12O6+6O2 b.2CO2 + 6H2 C2H5OH +3H2O
C2H5OH +3H2O
c.CO2 + CH4 CH3COOH d.2CO2 + 6H2
CH3COOH d.2CO2 + 6H2  CH2=CH2 + 4H2O
CH2=CH2 + 4H2O
以上反应中,最节能的是 ,反应b中理论上原子利用率为 。

N2(g)+2CO2(g) △H = -746 kJ·mol-1平衡时,NO的转化率与温度、压强的关系如图所示。